En 30 años, desde 1993 a 2023, hemos transitado desde un descubrimiento de investigación básica, la existencia de curiosas repeticiones de secuencias de ADN en el genoma de microorganismo procariotas, como las bacterias y las arqueas, aparentemente sin ninguna utilidad, hasta la aprobación de una terapia génica innovadora basada en ese hallazgo fundamental. En este artículo recojo, en mi opinión, los 10 hitos más importantes que nos han llevado desde las salinas de Santa Pola a Casgevy, desde el descubrimiento de un sistema inmunitario que usan las bacterias para defenderse de los virus a la aprobación de la primera terapia que usa dichas herramientas #CRISPR para tratar dos enfermedades graves de la sangre: anemia falciforme y beta talasemia.
Desde 1993 a 2023, son 30 años de investigación, diez hitos para ir desde la ciencia básica a la aplicada.
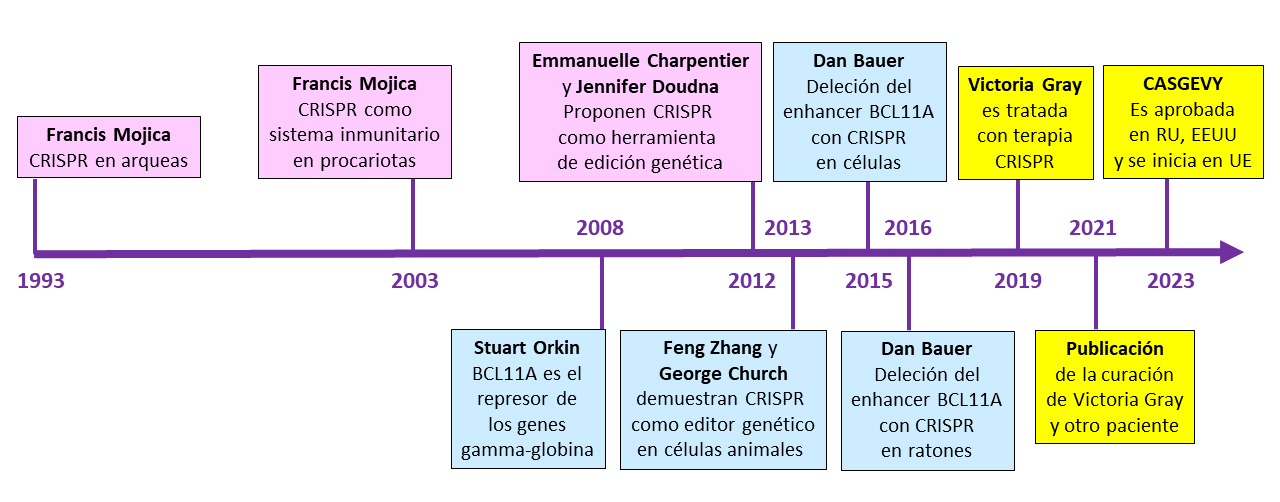
1993: Francis Juan Martínez Mojica, microbiólogo de la Universidad de Alicante, conocido popularmente como Francis Mojica, describe en una primera publicación (el segundo «paper» de su incipiente carrera científica) la existencia de unas curiosas secuencias de ADN repetidas, agrupadas y separadas por otras secuencias únicas en el genoma de una arquea (Haloferax mediterranei), un microorganismo procariota parecido a las bacterias, que habita en las salinas de Santa Pola (Alicante). No es el primero en fijarse en estas secuencias de ADN tan singulares. Antes que él unos microbiólogos japoneses, en 1987, las habían reportado en una bacteria gram negativa (Escherichia coli) y otros microbiólogos holandeses, en 1991, habían hecho lo propio en una bacteria gram positiva (Mycobacterium bovis BCG). Pero ni japoneses ni holandeses continuarán investigando esas secuencias. Será Francis Mojica quien se propondrá seguir investigándolas hasta llegar a entender para qué están ahí, cuál es su función. Y gracias a ese compromiso y perseverancia nacerá la revolución CRISPR que llegará hasta la actualidad.
2003: En el verano de 2003 Francis Mojica vive su particular momento ¡Eureka! tras analizar muchas de estas secuencias repetidas, al descubrir que algunas de las secuencias de ADN únicas intercaladas entre las secuencias repetidas en el genoma de bacterias y arqueas corresponden a fragmentos del genoma de bacteriófagos, virus que infectan a procariotas. Y añade una segunda observación que a la postre resultará fundamental: las bacterias que contienen uno de esos fragmentos de ADN de un determinado virus son inmunes, resistentes a la infección por ese virus. Lo que le lleva a proponer que estas curiosas repeticiones que alternan con secuencias únicas vírales constituyen elementos de un sistema de defensa adaptativo, un sistema inmunitario en procariotas. Tras numerosos rechazos en revistas top, ante la incredulidad de la comunidad científica, acaba publicando esta idea en 2005. Cuatro años antes, en noviembre de 2001, se le ocurre un nombre para estas secuencias: CRISPR (clustered regularly interspaced short palindromic repeats), acrónimo en inglés que describe lo que representaban originalmente estas secuencias de ADN. El nombre CRISPR se usa por vez primera en 2002, acreditando la paternidad de Francis Mojica. Y así es como este nombre, CRISPR, nacido en Alicante acaba en boca de todo el mundo en los años siguientes.
2008: El laboratorio del investigador Stuart Orkin, del Hospital Pediátrico de Boston, descubre una proteína represora, BCL11A, que parece ser la responsable de la regulación de los genes gamma-globina, componentes de la hemoglobina fetal. BCL11A mantiene silenciado elsos genes gamma-globina en adultos, permitiendo la expresión del gen beta-globina. Esta primera observación anticipa un potencial uso terapéutico si se consiguiera reducir o interferir la expresión del gen BCL11A, promoviendo con ello la reactivación de la gamma-globina fetal que podría substituir la ausencia o bajo nivel de expresión de la beta globina (en beta-talasemias) o la presencia de mutaciones patogénicas que conllevan graves problemas (en anemia falciforme).
2012: Las investigadoras Emmanuelle Charpentier y Jennifer Doudna publican, en la revista Science en el verano de 2012, el resultado de una colaboración científica por la cual describen los componentes básicos necesarios y suficientes para que un sistema CRISPR de una bacteria, Streptococcus pyogenes, puede funcionar como una herramienta de edición genética in vitro, en el laboratorio (una guía sintética de ARN y una nucleasa Cas9) y proponen que este uso podría extenderse in vivo para la edición de cualquier genoma de cualquier organismo. Ocho años después, en octubre de 2020, recibirán merecidamente el Premio Nobel de Química por este artículo, por «el desarrollo de un método de edición genética». La Real Academia Sueca de Ciencias decide dejar fuera a Francis Mojica del galardón, así como a muchos otros investigadores que habían contribuido al desarrollo de las herramientas CRISPR.
2013: Los investigadores Feng Zhang y George Church, trabajando de forma independiente, publican sendos artículos pioneros en la revista Science en enero de 2013 (artículo de Zhang, artículo de Church) en los que demuestran que la propuesta de las dos investigadoras Charpentier y Doudna era posible llevarla a la realidad, realizando las primeras ediciones genómicas en células de mamífero en cultivo, de ratón y humanas. Estas publicaciones (en especial la de Feng Zhang, del Instituto BROAD) desatan una guerra de patentes CRISPR, que se salda, por el momento, con la titularidad de la patente en EE.UU. para el Instituto BROAD/Editas Medicine [Zhang] y en Europa para Caribou Biosciences/ERS Genomics [Doudna/Charpentier]. Las derivadas de estas batallas de patentes las encontraremos en 2023 a la hora de aplicar las primeras terapias CRISPR en todo el mundo.
2015: El laboratorio de Dan Bauer, uno de los delfines científicos de Stuart Orkin, demuestra por vez primera que es posible reducir la expresión del gen BCL11A sin eliminarlo completamente (lo cual es inviable) mediante la deleción del enhancer (el potenciador transcripcional) llevada a cabo usando la tecnología CRISPR. Este es el primer paso para reactivar la producción de gamma-globina fetal, como substituta de la beta-globina en la hemoglobina afectada en anemia falciforme y beta talasemia.
2016: Ensayos preclínicos en modelos animales. Una nueva colaboración científica entre los laboratorios de Bauer y Orkin demuestra que la eliminación de las secuencias de ADN homólogas al enhancer del gen BCL11A en el genoma de ratón se traduce, como se había visto anteriormente en células en cultivo, en la reactivación del gen de las gamma-globinas en estos animales editados, sin observarse otros problemas o efectos secundarios inesperados. Tras el éxito de estos primeros (y otros) estudios pre-clínicos se autoriza el primer ensayo clínico (fases 1, 2 y 3) para validar esta propuesta terapéutica, que empieza en 2018.
2019: Durante 2019 se obtienen los primeros resultados exitosos en células hematopoyéticas humanas confirmando que la estrategia CRISPR para reducir la expresión del gen que codifica el represor BCL11A funciona, y que es posible reactivar con ella la expresión de los genes fetales de las gamma-globinas, que de forma natural permanecen inactivos en la vida adulta, reprimidos por BCL11A. El laboratorio de Dan Bauer obtiene estas evidencias y lo publican en Nature en mayo de 2019. El 2 de julio de 2019 la paciente norteamericana Victoria Gray, con anemia falciforme, recibe esta terapia experimental CRISPR. La terapia supone una única administración de células madre de la sangre editadas (con el enhancer del gen BCL11A eliminado), tras haber sido obtenidas antes de la propia paciente, y tras haber expuesto la paciente a dosis elevadas de quimioterapia para eliminar todo resto de células madre hematopoyéticas en la médula ósea antes de reintroducir las editadas.
2021: Se publican los resultados del tratamiento a Victoria Gray, y de otro paciente con beta talasemia, en la revista New England Journal of Medicine (NEJM) que confirman, tras 18 meses sin transfusiones sanguíneas, sin dolores, sin episodios de embolias u oclusión vascular, que la gamma-globina fetal ha ido reemplazando progresivamente la beta-globina mutada. La hemoglobina de Victoria Gray está ahora formada por dos cadenas alfa-globina y dos cadenas gamma-globina (en lugar de las dos cadenas beta-globina defectuosas). Un éxito incontestable de la propuesta terapéutica innovadora basada en las herramientas CRISPR.
2023: El 16 de noviembre de 2023 la agencia reguladora británica MHRA autoriza por vez primera el uso clínico de la terapia CRISPR para tratar a pacientes de anemia falciforme y beta talasemia a partir de los 12 años con el nombre comercial de Casgevy, producida por las empresas Vertex Pharmaceuticasl y CRISPR Therapeutics. La agencia reportó problemas de salud graves encontrados en 3 pacientes de los 54 tratados con beta-talasemia. No se reportaron efectos secundarios graves en ninguno de los 43 pacientes tratados con anemia falciforme. 39 de 42 pacientes con beta talasemia resultaron curados y libres de enfermedad 12 meses después del tratamiento. 28 de 29 pacientes con anemia falciforme resultaron curados y libres de enfermedad 12 meses después del tratamiento. El día 8 de diciembre la FDA aprobó Casgevy para tratar a pacientes con anemia falciforme. La FDA reportó la curación efectiva tras 12 meses después del tratamiento en 29 de 31 pacientes tratados, con diversos efectos secundarios considerados de baja gravedad. Finalmente, el día 15 de diciembre de 2023 el comité CHMP (Committee for Medicinal Products for Human use) de la Agencia Europea del Medicamento (EMA) recomendó la autorización de esta misma terapia CRISPR para los pacientes de anemia falciforme y beta talasemia de la Unión Europea, basándose en los mismos datos clínicos que habían sido utilizados por la agencia británica MHRA. A diferencia de las aprobaciones en el Reino Unido y en EE.UU. la recomendación de autorización de la EMA todavía deberá seguir un recorrido legal y burocrático antes de poder ser administrada a los pacientes en algún estado miembro de la Unión Europea.
Nota final: La terapia CRISPR Casgevy se administrará en EE.UU. a un precio de 2,2 millones de dólares por paciente. La empresa Vertex Pharmaceuticals formalizó un acuerdo no-exclusivo de licencia CRISPR con Editas Medicine (quien tiene la licencia en exclusiva de la patente CRISPR del Instituto BROAD, aplicable solamente en los EE.UU.) por unos 200 millones de dólares para poder usar la tecnología CRISPR en EE.UU. con objetivos terapéuticos.


Esto de la genetica es excelente ,por el momento el tratamiento es muy elevado,en mi caso tengo una hija que padece de anemia falciforme,que alguna institucion nos ayude para que puedan tratarla,porque el costo de 2.2 millones de dolares,para yo que soy peruano imposible de tener esa cantidad,pero hay instituciones que nos pueden ayudar,espero con ansias ese dia que mi hija pueda ser tratada de anemia falciforme y pueda vivir como todo ser humano.
Ponderado aporte al Bienestar humano y ecosistémico futuro basado en la Microecobiología,