El jueves 16 de noviembre pasará a ser un nuevo día histórico de la biomedicina: el día que una agencia reguladora aprobó por vez primera una terapia basada en las herramientas CRISPR de edición genética. Ha sucedido en el Reino Unido, y la agencia reguladora responsable de la aprobación ha sido la MHRA (Medicine & Healthcare products Regulatory Agency). La terapia ha recibido el nombre de Casgevy y ha sido desarrollada conjuntamente por las empresas Vertex Pharmaceuticals y CRISPR Therapeutics para el tratamiento de personas mayores de 12 años afectadas por anemia falciforme con crisis recurrentes de oclusión vascular o por beta-talasemia dependiente de transfusiones, para las que no existan donantes de médula ósea compatibles HLA para realizar un trasplante, que es el tratamiento inicialmente indicado para estos pacientes. Se cree que en el Reino Unido existen unas 2.000 personas que podrán beneficiarse de esta nueva terapia.
Tanto la anemia falciforme (1:5.000-10.000) como la beta-talasemia (1:100.000) son enfermedades raras, de baja prevalencia en la población. La anemia falciforme puede llegar a ser de las enfermedades raras más frecuentes, con alrededor de 1:2300 personas al nacer en Europa. En ambos casos la proteína afectada es la hemoglobina, formada por cuatro cadenas, dos de alfa-globina y dos de beta-globina, encargada de transportar el oxígeno desde los pulmones a todas las células del cuerpo. La hemoglobina se acumula dentro de los glóbulos rojos, o hematíes, que son el vehículo que la transporta a a todos los rincones de la anatomía a través de los vasos sanguíneos. En el caso de la anemia falciforme el gen que codifica la beta-globina presenta una mutación específica en el sexto aminoácido de la proteína (Glu6Val), que la inactiva y provoca que se aglomere (polimeriza) dentro del glóbulo rojo, que acaba adoptando una forma alargada, como de cayado u hoz (de ahí su nombre tanto en español como en inglés: sickle-cell disease). Además de reducirse de forma significativa la capacidad de transportar oxígeno estos glóbulos rojos anómalos acaban ocluyendo vasos sanguíneos por todo el cuerpo, provocando embolias por doquier, que pueden llegar a ser fatales. Los pacientes de anemia falciforme están expuestos a crisis vasculares recurrentes y requieren transfusiones de sangre constantes o un trasplante de médula de un donante compatible para que el sistema hematopoyético vuelva a producir glóbulos rojos normales. En el caso de la beta-talasemia el gen de la beta-globina o bien está alterado, y se expresa de forma reducida, o está prácticamente inactivado, alterando la producción de hemoglobina y necesitando igualmente trasplante de médula o transfusiones de sangre regulares para mantener el aporte de oxígeno desde los pulmones a las células del cuerpo.
Anualmente nacen en el mundo alrededor de 400.000 personas con anemia falciforme, la mayoría de ellas en África. Allí la expectativa de vida es muy limitada y, sin tratamiento, la mitad de ellas no llegarán a cumplir los 5 años. En el mundo occidental la mortalidad es del 1%, similar a la observada en el caso de la pandemia COVID-19 causada por el coronavirus SARS-CoV-2. La hidroxiurea es un tratamiento aprobado en Europa y en otros países del mundo para el tratamiento crónico de la anemia falciforme dado que promueve la síntesis de la variante fetal gamma-globina que puede suplir la beta-globina y reducir el número de glóbulos rojos en forma de cayado, aunque no está exenta de efectos secundarios.
El tratamiento aprobado Casgevy es una terapia génica y celular de las llamadas ex-vivo, es decir, que se realizan sobre células troncales hematopoyéticas (CD34+, las que son capaces de producir todas las células de la sangre, incluidos los glóbulos rojos) extraídas del propio paciente que son editadas genéticamente en el laboratorio con las herramientas CRISPR y luego, tras ser seleccionadas, son retornadas al mismo paciente tras realizar un acondicionamiento, es decir, tras eliminar sus propias células hematopoyéticas defectuosas, portadoras de la mutación en el gen de la beta-globina, que pasan a ser substituidas por las células editadas en el laboratorio. El tratamiento surge de una investigación básica, desarrollada originalmente en el laboratorio de Stuar Orkin (Children’s Boston Hospital) y de varios de sus discípulos, como Daniel Bauer. La base de esta terapia la expliqué en 2019 en otro artículo de este blog que titulé «Curando reprimiendo al represor«.
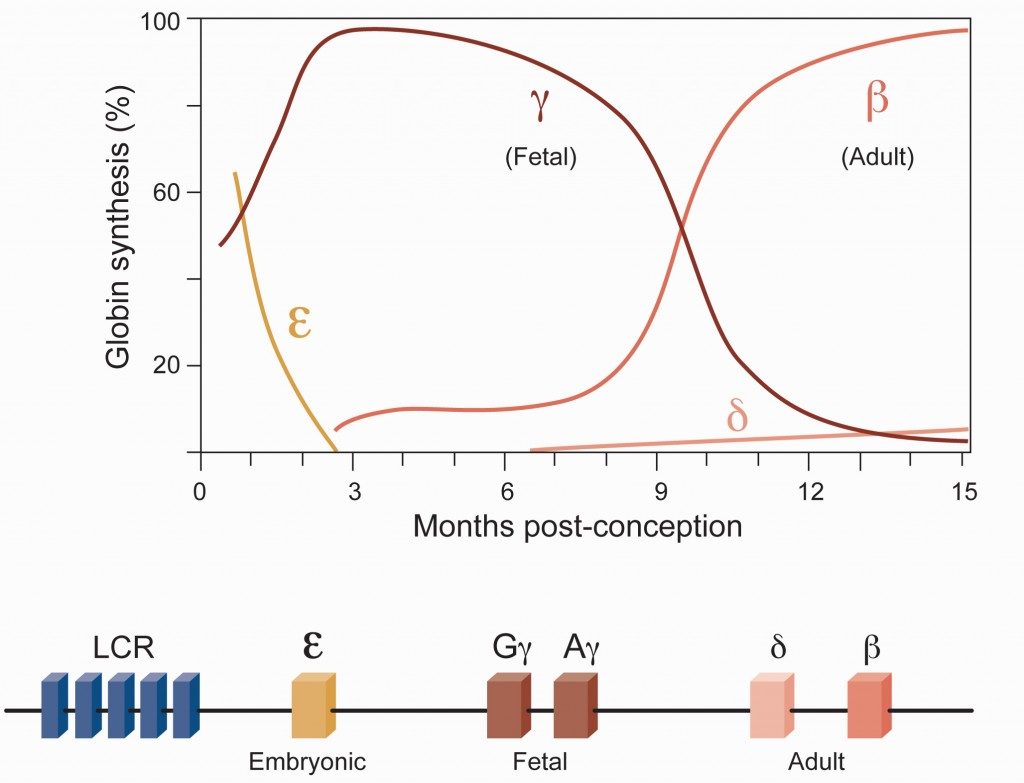
Mientras nos desarrollamos en el útero de nuestra madre la función de la beta-globina la realiza, en primer lugar, la epsilon-globina (ε-globina), que desaparece hacia los tres meses de gestación, siendo substituida por la gamma-globina (γ-globina) que es la prevalente durante el desarrollo fetal. Sin embargo, al nacer, se produce un cambio brusco en la expresión de estos genes. El gen de la gamma-globina deja de funcionar, queda reprimido, y en su lugar se activa el gen de la beta-globina, que es el que funcionará el resto de la vida. La inactivación postnatal de los genes gamma-globina (hay dos, Gγ y Aγ) es debida a la irrupción de una proteína represora: BCL11A, que interacciona con el promotor de estos genes y bloquea su expresión el resto de la vida adulta de esa persona.
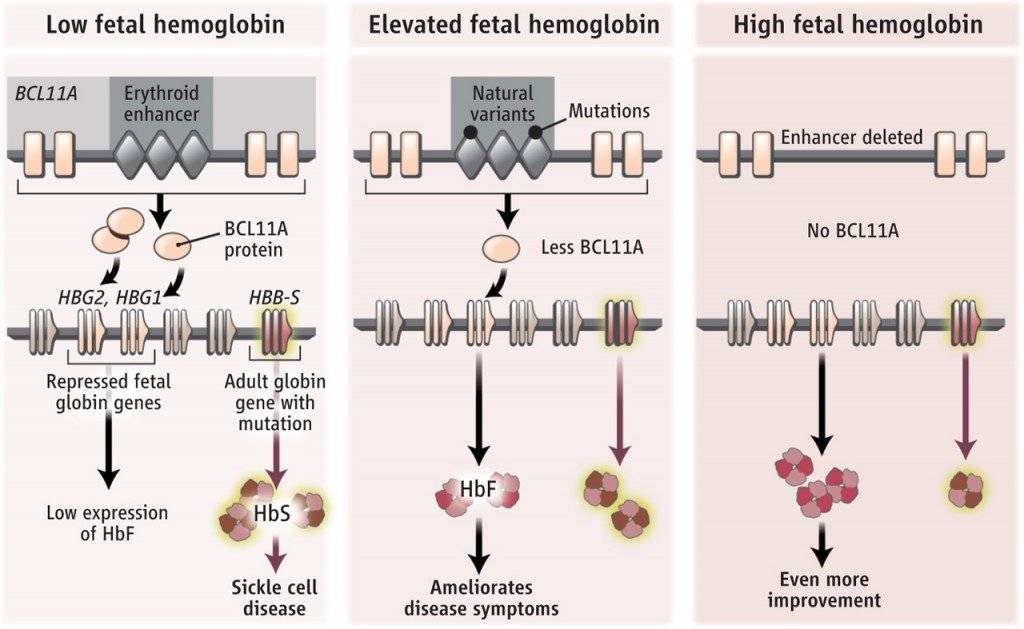
No se puede eliminar completamente el represor BCL11A pues realiza otras funciones en el desarrollo del sistema hematopoyético, pero sí que se puede reducir su nivel de expresión, atacando mediante las herramientas CRISPR la zona del gen que contiene los potenciadores transcripcionales (enhancer en inglés). De esta manera, delecionando la zona que contiene los elementos reguladores de la expresión génica del gen BCL11A se consigue reducir la cantidad de proteína BCL11A producida, de forma significativa, lo cual permite que se reactiven espontáneamente los genes gamma-globina en adultos, cuando deberían estar silenciados. La reactivación de los genes gamma-globina permite que substituyan al gen beta-globina mutado (en anemia falciforme) o con la expresión alterada (en beta-talasemia) con lo que se restituye la actividad de la proteína hemoglobina y la persona ya nunca más necesitará transfusiones sanguíneas ni deberá preocuparse por los temibles episodios de embolias y otras oclusiones vasculares, dolorosísimas y a veces fatales.
La investigación básica está en el origen de esta terapia CRISPR que ahora se ha aprobado de forma pionera en el Reino Unido. La propuesta de usar la inactivación del represor BCL11A para reactivar los genes de las gamma-globinas surge del laboratorio de Stuar Orkin en 2008, hace 15 años (!), y posteriormente ya se retoma en 2011 en una revisión en la que ya participa Daniel Bauer. Al año siguiente, 2012, ya proponen bloquear la expresión del gen BCL11A para reactivar la hemoglobina fetal. En 2013 Bauer y Orkin encuentran el enhancer del gen BCL11A y proponen usarlo para reducir la expresión de este gen de forma significativa. En primer lugar, en 2015, exploran el uso de ARN de interferencia para reducir la expresión del gen, pero a finales de ese año dan con la solución definitiva al empezar a usar las herramientas CRISPR-Cas9 para delecionar el citado enhancer, y constatar la reactivación de los genes gamma-globina, lo que abre las puertas a una futura terapia. En 2016 comprueban en modelos pre-clínicos animales (en ratones) que esta estrategia terapéutica permite reactivar los genes gamma-globina in vivo. Y a partir de 2018 empiezan los ensayos clínicos de fase 1, 2 y 3 para evaluar la seguridad y eficacia de esta terapia en pacientes de anemia falciforme. El 2 de julio de 2019 los investigadores trataron a la paciente Victoria Gray, con anemia falciforme, con esta terapia y 18 meses después describieron en un artículo en New England Journal of Medicine (NEJM) el éxito del mismo. El artículo apareción online a finales de 2020 y fue publicado a principios de 2021. La beta-globina mutada había sido substituida por la gamma-globina reactivada. Resultados igualmente positivos se obtuvieron con una primera paciente de beta-talasemia, consiguiéndose la reactivación de los genes gamma-globina que substituyeron a la beta-globina. Fueron los primeros pacientes de muchos más que siguieron siendo tratados en los ensayos clínicos y que, en su gran mayoría, resultaron curados para siempre tras este tratamiento ahora aprobado.
Yo tuve ocasión de conocer y saludar a Victoria Gray en Londres, en marzo de 2023, durante la tercera cumbre internacional de edición genética en humanos, a la que asistí. Era una persona corriente, que había estado enferma de anemia falciforme durante toda su vida pero que ahora era feliz, y mostraba un agradecimiento extraordinario a la ciencia, a los investigadores que habían desarrollado esta terapia experimental que a ella le había solucionado su enfermedad, dejándola curada de por vida. Parecía un milagro, pero no lo era. Son los avances científicos los que consiguieron curar a Victoria Gray.
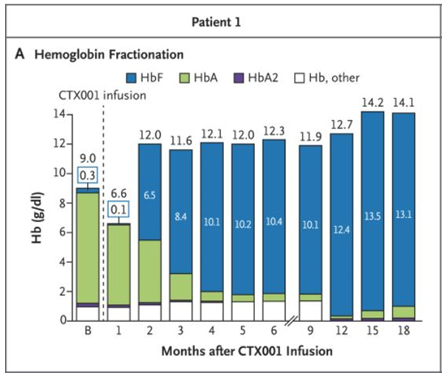
La terapia CRISPR llamada Casgevy se esperaba que sería aprobada por la agencia norteamericana FDA (cuyo comité asesor ya había dado luz verde a la terapia, considerando que era suficientemente segura para ser llevada a pacientes) o por la agencia europea EMA (que sin embargo había acordado ya la denominación de medicamente huérfano para esta terapia, tanto para tratar a pacientes de beta-talasemia como anemia falciforme). Sin embargo no hay sido ninguna de las dos quien ha decidido autorizar el tratamiento de forma pionera, sino la agencia británica MHRA, según informa la revista Nature. En la web de la MHRA podemos ver las especificaciones del producto Casgevy, y la información para pacientes y cuidadores. Los ensayos clínicos se han realizado sobre 45 pacientes de anemia falciforme y 54 pacientes de beta-talasemia grave. De los primeros, 29 han podido ser monitorizados durante al menos un año y 28 de ellos han resultado curados, sin muestras de dolor ni necesitar más transfursiones. De los segundos, 42 han sido investigados durante más de un año y 39 de ellos no han requerido ninguna otra transfusión. Estos éxitos incontestables han catapultado la aprobación de este primer tratamiento CRISPR.
La colaboración entre dos empresas farmacéuticas, Vertex Pharmaceuticals y CRISPR Therapeutics ha sido clave para desarrollar, testar y ahora aprobar esta primera terapia CRISPR. La empresa CRISPR Therapeutics fue fundada por la premio Nobel de Química 2020, Emmanuelle Charpentier. En estos momentos hay casi un centenar de ensayos clínicos en marcha usando diversas versiones de las herramientas CRISPR.
A pesar del éxito del tratamiento hay un par de aspectos que registran la preocupación de investigadores y de la sociedad en general.
En primer lugar, se ha descubierto a principios de este año que una de las guías ARN usadas por la estrategia CRISPR para eliminar el enhancer del gen BCL11A resulta que puede aparearse con otra secuencia génica, del mismo cromosoma, en personas de origen afroamericano (las que mayormente sufren esta enfermedad). La existencia de un SNP hace aparecer una diana extra para esta guía ARN en el gen CPS1 que no está presente en el resto de la población. En el laboratorio se han comprobado las mutaciones inducidas en este sitio inesperado y hasta las inversiones que puede suscitar. No está claro cómo puede influir sobre los pacientes afroamericanos. Hasta el momento ninguno de los pacientes tratados con estas guías han mostrado problemas adicionales no relacionados con el tratamiento de su anemia falciforme. Pero habrá que estar atentos y monitorizar a todos los pacientes tratados durante un tiempo suficientemente largo para dilucidar si la terapia genera, o no, problemas adicionales. En otros ensayos clínicos de terapias CRISPR, como la que está investigando VERVEX Pharmaceuticals, usando editores de bases (herramientas CRISPR de segunda generación) para disminuir el nivel de colesterol mediante la inactivación del gen PCSK9, represor del receptor de las lipoproteínas de baja densidad, que transportan el colesterol, se han constatado diversos efectos secundarios graves, que han supuesto incluso la muerte de 1 de los 10 pacientes tratados inicialmente, mientras que otro ha sufrido un ataque al corazón del que ha podido recuperarse, según informa Nature.
En segundo lugar, se espera que el coste de esta nueva terapia CRISPR para tratar anemia falciforme o beta-talasemia oscile entre 2 y 3 millones de dólares por paciente. Este es un precio que seguramente no podrán abonar la mayoría de pacientes de anemia falciforme, la mayor parte de ellos en África. Y este es el verdadero problema al que se enfrentan estas terapias experimentales de última generación. Un problema que ya no es científico ni técnico, sino económico. Las empresas farmacéuticas (a las que sin duda necesitamos para producir los medicamentos de forma segura y robusta) deben poder resarcirse de forma legítima de la inversión realizada, considerando todos los demás medicamentos desarrollados y testados que no han llegado a ser aprobados y han tenido que ser descartados, el coste de ahorro que para los sistemas nacionales de salud supone dejar de tratar un paciente crónico de por vida, y, en mucha menor medida, el coste de producción del medicamento en sí mismo. Pero eso debe poder ser compatible con un precio razonable, asumible por los sistemas nacionales de salud, que pueda ser pagado y permita el acceso a estas terapias. De no ser así estaríamos vulnerando el cuarto principio de bioética, que nos recuerda que todos los tratamientos que desarrollemos deben poder ser accesibles para toda aquella persona que lo necesite, no solamente para aquellas que puedan costeárselo. Resulta obvio pensar que estos precios tendrán que descender a cantidades más razonables, lo antes posible.
¿Qué puede haber peor que tener un hijo con una enfermedad rara? Tener un hijo con una enfermedad rara, saber que existe una terapia para curarlo y no poder acceder a ella.


https://www.managedhealthcareexecutive.com/view/a-first-crispr-based-gene-editing-therapy-for-ldl-cholesterol-lowering-in-humans-aha-scientific-sessions
Lo he leído hoy, poco antes de encontrar el tuyo. Seguramente se hubiera muerto de todas maneras, pues tenía graves problemas de corazón, pero en cualquier caso
…una de cal y otra de arena…
Se agradece enormemente la labor de divulgación, de gran valor académico. Comentare esta reseña con mis alumnos de los Grados de Bioquímica y Biotecnología, en la sección del curso que denomino «Lo que un bioquímico y biotecnólogo debe de conocer del dia a dia en los avances de la ciencia y su aplicación biomédica, agroalimentaria, medioambiental, e industrial». Me parece importante comentar y discutir los avances científicos, situándolos en un contexto político-social y económico. Hay que saber diferenciar las posibilidades que abren los avances en la investigación básica y su aplicación. Gracias por este excelente artículo.
Muchas gracias Jesús. Para eso publico estos artículos también, para que quienes podéis llevar estos avances a las aulas los utilicéis para actualizar con información rigurosa lo que podemos hacer y las consecuencias de todo ello. Gracias
Gracias Luis. Excelente resumen. Esperanza para nuestros pacientes, pero sin abandonar la cautela. Sigamos el camino trazado: cribado neonatal, guías de tratamiento, apoyo psicosocial, acceso a ensayos y terapias curativas (trasplante y edición genica)
Muchas gracias Elena!
Gracias! Como madre de una niña con una enfermedad genética ultra rara ojalá algún día se pueda ultizar esta técnica para todos. CRISPR CASH-9 ya hce tiempo sigo su nombre
Muy emocionante y esperanzador
Maravilloso. El uso de la edición génica será CURAR y no sólo TRATAR una enfermedad no sólo congénita sino GENÉTICA
Muchas gracias por tantos artículos tan bien explicados, y fáciles de entender. Los utilizo con mucha frecuencia en charlas con grupos de personas interesadas en la biotecnología. No tienen gran base de ciencias, y tu forma de explicar temas complejos facilita mucho que entiendan, por lo menos, las líneas principales. Otra vez gracias.
Muchas gracias Mertxe, muy amable!
Buen día,
Disculpen habrá terapia génica para MPS II??? Mi hijo tiene 4 años y ha sido diagnosticado recientemente
Muchas gracias
Existen numerosos ensayos clínicos, algunos ya completados, otros todavía en marcha, para tratar el síndrome de Hunter (MPS II)
https://www.clinicaltrials.gov/search?cond=MPS%20II