
Pocas personas existen en la actualidad que puedan decir que su trabajo ha contribuido a salvar millones de vidas humanas. La investigadora Katalin Karikó es una de ellas. Sus investigaciones de ciencia básica sobre el ARN, iniciadas hace cuatro décadas, y su férrea voluntad de convertirlo en una herramienta terapéutica dieron sus frutos a principios del año 2020, cuando descubrimos la existencia de la pandemia COVID-19, causada por el coronavirus SARS-CoV-2, y dos empresas, la alemana BioNTech y la norteamericana Moderna, se pusieron a desarrollar sendas vacunas basadas en la tecnología del ARNm que ella, junto al investigador Drew Weissman, descubrieron. Somos hoy millones de personas en todo el mundo quienes hemos recibido una o varias dosis de las vacunas COVID-19 de Pfizer/BioNTech o Moderna, cuyo origen se remonta a la curiosidad, perseverancia y serendipia que iluminaron siempre el trabajo de esta investigadora, a través de una labor callada, alejada de los focos, pero con tenacidad y decisión. De alguna manera veo un cierto paralelismo entre el trabajo de investigación básica, a veces incomprendido o tratado con desdén, de Karikó con el de Francis Mojica. Creo sinceramente que esta investigadora es ejemplar en muchos sentidos. Ha empezado a recoger premios (como el Princesa de Asturias o el Breakthrough Prize, los dos concedidos en 2021, junto a otros investigadores), que merecidamente reconocen su extraordinaria contribución al desarrollo de las vacunas COVID-19 basadas en ARNm, y probablemente, más pronto que tarde, pueda también recoger el máximo galardón que un científico puede recibir: el premio Nobel. Este artículo pretende glosar sucintamente su trayectoria profesional.
Katalin Karikó nació el 17 de enero de 1955 en Szolno (Hungría) y creció en Kisújszállás, localidad situada a unos 150 km al este de Budapest. Su familia, muy humilde, vivía en una casa de una sola estancia, hecha con adobe, sin agua corriente, ni nevera ni televisor. Sin electricidad. Su padre era carnicero. Ella misma indica que de la observación de la labor de su padre como matarife, despiezando los animales y separando los órganos, quizás le venga su interés por la biología. Descubro con sorpresa y admiración que compartimos el despertar de nuestras vocaciones científicas en biología de la mano de matarifes, como conté hace algunos años. Ella se concentró en sus estudios y logró quedar en tercera posición de un concurso nacional de biología, cuando tenía 14 años. Se graduó en Biología por la Universidad de Szeged, Szeged (Hungría) en 1978 y obtuvo el doctorado en Bioquímica, por esa misma universidad, en 1982. Tras finalizar su tesis continuó su labor científica como investigadora postdoctoral en el mismo instituto, el Centro de Investigaciones Biológicas de la Academia de Ciencias de Hungría, en Szeged, hasta 1985, cuando decidió salir del país para no regresar y poner rumbo a las Américas. Su primer artículo científico publicado está fechado en esos años, 1985, investigando el uso de liposomas para transfectar ADN en células. Estuvo valorando incorporarse al grupo dirigido por el investigador Luis Carrasco, experto virólogo en el Centro de Biología Molecular Severo Ochoa, (CBMSO-UAM/CSIC) en Madrid, recientemente jubilado (2020), o incluso trasladarse a Francia, pero finalmente optó por cruzar el charco y dejar atrás la Hungría comunista de entonces. Decidida, vendió su coche en el mercado negro, cosió el dinero que obtuvo (~1.000 €) dentro del peluche de su hija de 2 años (Hungría solo dejaba sacar 100 dólares del país), y junto a su marido ingeniero emigró a EE.UU., sin conocer a nadie. Su hija Susan, acabaría convirtiéndose en deportista y ganaría sendas medallas de oro olímpicas en remo en los Juegos de Pekín (2008) y Londres (2012), representando a EE.UU. El ejemplo de trabajo, perseverancia y tenacidad, y el compromiso ético de su madre fueron decisivos en su carrera.

El interés principal que ha tenido Katalin Karikó durante toda su carrera científica ha sido el de desarrollar terapias que estuvieran basadas en el uso de ARNm como vehículo para promover la síntesis de las proteínas terapéuticas. Y eso fue lo que intentó desarrollar, desde que aterrizó en EE.UU. como investigadora postdoctoral, primero en el departamento de Bioquímica de la Temple University, en Filadelfia (Pensilvania, EE.UU.), entre 1985 y 1988, y posteriormente en el departamento de Patología de la USUHS, en Bethesda (Maryland, EE.UU.), entre 1988 y 1989. En Temple University tuvo ocasión de participar en un ensayo clínico pionero que pretendía evaluar el potencial terapéutico del ARN de doble cadena (dsRNA) como terapia antiviral contra el SIDA, respuesta mediada por el interferón.
En 1989 regresó a Filadelfia, esta vez como Research Assistant Professor (Profesor Ayudante Doctor en nuestra escala académica) del departamento de Medicina de la Universidad de Pensilvania (UPENN), en el laboratorio de Elliot Barnathan, un cardiólogo e investigador, que la contrató para que le ayudara a recabar fondos. Y allí empezó a solicitar ayudas tanto a instituciones públicas como a empresas para poder llevar a cabo sus propuestas experimentales con ARNm. Sin embargo, la mayoría de los proyectos que remitió no fueron financiados. La empresa Merck & Co (MSD) rechazó financiar su investigación a pesar de que Katalin Karikó apenas solicitaba 10.000 USD para sus experimentos, una cantidad ridícula si la comparamos en la actualidad con los centenares de millones de dólares que han generado las empresas BioNTech y Moderna con su tecnología de ARNm. Fue en esos años, finales de los 80 y principios de los 90, cuando Katalin Karikó recabó las primeras evidencias de que el ARNm podría funcionar como estrategia terapéutica, al constatar la producción de proteínas derivadas de ARNm introducidos en células, mientras seguía colaborando en diversos trabajos científicos encaminados a desarrollar estrategias terapéuticas contra el cáncer. En 1990 otros investigadores demostraron que se podía usar ADN o ARN para sustentar la expresión génica in vivo, en ratones. Karikó sabía que eso eran buenas noticias, pero quería ir más lejos, y evitar la conocida inestabilidad y degradación de las moléculas de ARN cuando entraban en las células. Sin embargo, la falta de financiación y publicaciones bloquearon su promoción y la UPENN le retiró el contrato de Research Assistant Professor en 1995, cuando Elliot Barnathan se fue a una empresa privada y ella se quedó sin laboratorio ni fondos para trabajar. Probablemente la universidad esperaba que ella se fuera, y abandonara. Pero no lo hizo. Aceptó pasar a ser de nuevo una investigadora postdoctoral (Senior Research Investigator), adscribiéndose al departamento de Neurocirugía de la misma universidad, en el laboratorio de David Langer, que fue quien la «rescató». Karikó ocuparía esa posición durante los siguientes 14 años, hasta 2009, sin volver a ser promocionada. Katalin Karikó no tenía la residencia norteamericana y necesitaba tener un salario para seguir trabajando en EE.UU., aunque fuera en un puesto más precario y no permanente. Decidió primar sus intereses científicos a su proyección personal y siguió apostando por investigar el uso terapéutico del ARNm, en contra de las recomendaciones de la universidad, que consideraban que este proyecto no tenía futuro, decisión que seguramente ahora lamentan. Durante años, Katalin Karikó fue saltando de laboratorio en laboratorio en la Universidad de Pensilvania, manteniendo su salario de investigadora postdoctoral y sin disponer de laboratorio propio.
El año 1995, cuando la Universidad de Pensilvania retiró el contrato de Research Assistant Professor, degradándola a investigadora postdoctoral, fue un año duro para Katalin Karikó en lo personal, pues tuvo que superar un cáncer y su marido tuvo que afrontar diversos problemas para renovar la visa en Hungría. Estuvo a punto de tirar la toalla, pero decidió seguir con los experimentos y se propuso intentar hacerlo mejor, todo lo mejor que pudiera.
En 1997 el investigador Drew Weissman aceptó una posición como Research Assistant Professor (equivalente a la que había perdido Karikó) de Medicina, en la Facultad de Medicina de la Universidad de Pensilvania, tras haber pasado varios años trabajando en Bethesda, en el NIH, con Anthony Fauci, intentando desarrollar terapias efectivas y una vacuna eficaz contra el SIDA. Karikó se había quedado de nuevo sin laboratorio, con la partida de David Langer. Pero la serendipia estaba esperando a la vuelta de la esquina. En efecto, un encuentro fortuito en la fotocopiadora (sería un photocopier pitch, similar a un elevator pitch) entre Karikó y Weissman propició una primera conversación sobre el potencial terapéutico del ARNm y los problemas no resueltos que debía afrontar esta estrategia. Weissman le comentó que quería desarrollar una vacuna contra el SIDA y Karikó le contestó que ella era una investigadora especialista en ARN, que podía hacer cualquier cosa con el ARN. Y saltó la chispa, como tantas veces en ciencia, sea en un pub, en un paseo, en un café, en el ascensor o en una fotocopiadora. Y Katalin Karikó y Drew Weissman empezaron a colaborar. Esta colaboración sería la que les llevaría, pocos años después, en 2005, a descubrir la manera de evadir la respuesta inmune furibunda que suscitaba el ARNm y su inestabilidad y degradación al entrar en las células.
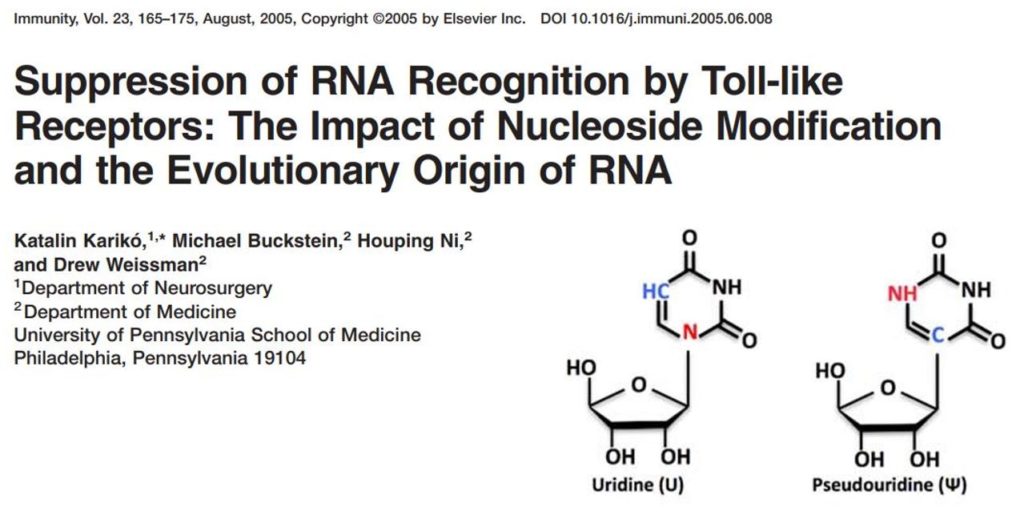
Se sabía que la introducción de ARNm en las células suscitaba una respuesta inmune innata e inespecífica, con activación de una potente respuesta inflamatoria suscitada por citoquinas. El organismo interpretaba que un intruso, un patógeno, quería acceder a la célula (teniendo en cuenta que muchos virus tienen al ARN como su material genético). La respuesta celular activaba el sistema del interferón y estaba mediada por los receptores celulares TLR (Toll-like receptor), en particular TLR3, TLR7 y TLR8. Karikó y Weissman demostraron en 2004 que el ARNm era el ligando del TLR3. La solución al problema llegó con la idea de substituir la Uridina de los ARNm por un nucleósido análogo, la Pseudouridina, químicamente muy similar, pero suficientemente diferente para evitar ser reconocido por los TLRs. Recordemos que los ribonucleótidos que conforman el ARN son cuatro: A, G, C y U. La U toma el papel de la T en el ADN.
La idea de utilizar pseudouridina (el verdadero momento ¡Eureka! de esta historia) llegó de la observación atenta de los controles de los experimentos. Se dieron cuenta que el ARNm sintético que usaban desataba esa reacción inmunitaria, mientras que el ARN que utilizaban de control, ARN de transferencia, ARNt, extraido de la misma célula, no provocaba la misma reacción. La explicación a ese comportamiento descubrieron que era debido a que la pseudouridina, de forma natural, ya estaba presente en los ARNt, los cuales, gracias a esa modificación, eran aceptados por la célula como propios. Y no se montaba la reacción inflamatoria que se observaba con los ARNm que los investigadores sintetizaban en el laboratorio a partir de ribonucleótidos A, C, G y U. Cuando Karikó y Weissman empezaron a introducir pseudouridinas en lugar de uridinas en sus ARNm de síntesis se dieron cuenta que aumentaba su estabilidad, se producía mucha más cantidad de proteína y durante más tiempo, y, lo más importante, no se activaba la tradicional respuesta inmunitaria inflamatoria que hasta el momento parecía un obstáculo insalvable. Habían resuelto el problema de la estabilidad y la reacción inmunitaria asociada al uso de ARNm.
El trabajo lo publicaron en la revista Immunity en 2005, (no sin antes afrontar también un reguero de rechazos a este trabajo por otras revistas). Inicialmente el artículo pasó relativamente desapercibido. Para su desesperación, los proyectos que solicitaron basados en su hallazgo tampoco tuvieron éxito inicialmente. Casi nadie creía que el ARNm fuera un buen candidato para convertirse en una molécula terapéutica, o para ser utilizado como vacuna. Sin embargo, ese artículo se convertiría, a la postre, en la referencia para todo el campo de desarrollo de terapias y vacunas basadas en ARNm. En el trabajo demostraban como el uso de la Pseudouridina (y otros nucleósidos análogos) reducía la producción de citoquinas, como la IL-8, en células.
Un año después de publicar su trabajo seminal, Karikó y Weissman fundaron una empresa, para desarrollar medicamentos basados en ARNm, empresa en la que Katalin Karikó se convirtió en CEO. Pero nunca llegaron a poder probar las moléculas en ensayos clínicos y la Universidad de Pensilvania cedió la licencia en exclusiva a otra empresa, Cellscript.
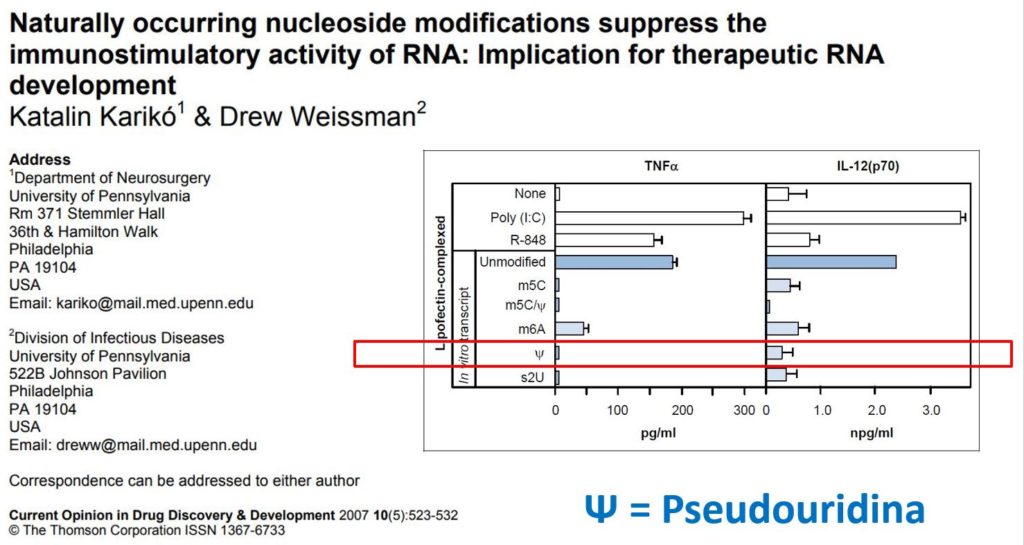
En los años siguientes Karikó y Weissman siguieron caracterizando la utilidad de substituir la Uridina por la Pseudouridina en los ARNm que sintetizaban, constatando en un trabajo publicado en 2007 que no solo se reducía la producción de la citoquina IL-8, como habían visto en 2005, sino también el TNFalpha y la IL-12. Ciertamente, con la humildad que la caracteriza, Karikó reconoce que estos trabajos abrieron el campo para el desarrollo de vacunas y terapias basadas en ARNm, pero igualmente reconoce que para el éxito de esas aplicaciones fueron necesarias muchas otras disciplinas y otros descubrimientos y el trabajo de muchos otros investigadores para que esa idea se convirtiera en realidad.
Efectivamente, faltaba combinar las modificaciones estructurales en el ARNm (Uridina por Pseudouridina) con algún sistema de encapsulación que fuera eficaz protegiendo a la molécula de ARNm y le permitiera entrar al interior celular para poder ser traducido y dar lugar a las proteínas que debían realizar su función terapéutica o propiciar una protección inmunitaria. Tras muchos intentos el éxito llegaría diez años después, en 2015, cuando el propio Drew Weissman, en colaboración con Katalin Karikó, pudo demostrar que las nanopartículas lipídicas (LNP) permitían transferir los ARNm in vivo, en ratones, administradas a través de varias rutas (intravenosa, intramuscular, subcutánea, intraperitoneal, intradérmica) lo cual permitía extender su capacidad de traducir y generar proteínas durante varios días. Exactamente lo que el campo necesitaba, y la prueba definitiva pre-clínica para iniciar los ensayos clínicos con estas alternativas terapéuticas y vacunales.

En los años siguientes, Weissman y Karikó aplicarían la tecnología de ARNm para el desarrollo de vacunas contra el virus Zika, contra el HIV, causante del SIDA, y contra la gripe. Hasta que en 2020 llegó el coronavirus SARS-CoV-2 y aplicaron, de nuevo, su tecnología, de nuevo con éxito, para desarrollar vacunas contra la COVID-19. Esa misma tecnología fue la que, muy rápidamente, empezando a principios de 2020, tan pronto se conoció la secuencia del ARN genómico del coronavirus SARS-CoV-2, adaptaron y utilizaron las empresas Moderna y BioNTech para desarrollar sus propias vacunas COVID-19, que fueron finalmente aprobadas para su uso en diciembre de 2020, tanto en EE.UU. como en Europa.
En 2009 la Universidad de Pensilvania finalmente corrigió su tremendo error, al haber despedido a Katalin Karikó del claustro de profesores en 1995, catorce años antes (!), y le ofreció una posición como Adjunct Associate Professor (Profesora Titular adjunta) en el departamento de Neurocirugía, cargo que sigue conservando. En 2013 Katalin Karikó se convirtió en Vicepresidenta de la empresa BioNTech, a quien la Universidad de Pensilvania había licenciado su patente de modificación del ARNm (de la misma forma que también licenció la misma tecnología a la empresa Moderna, fundada en 2010 por Derrik Rossi, un investigador canadiense especializado en células madre), y, a partir de 2019 se ha convertido en Vicepresidenta Senior de la empresa, compatibilizando su labor como investigadora académica y asesora de la empresa farmacéutica.
Permitidme añadir una nota adicional a toda esta historia, que es un canto a la diversidad cultural y a la integración. Katalin Karikó es una investigadora húngara emigrada a EE.UU. Drew Weissman desciende también de emigrantes italianos (de Sicilia, por parte de madre) y polacos (por parte de padre). Los investigadores Ugur Sahin y su esposa Özlem Türeci, fueron emigrantes turcos en Alemania, fundaron la empresa BioNTech en 2008, y actualmente la empresa, situada en Mainz (Alemania), está valorada en más de 25 mil millones de dólares y tiene 1.500 empleados. Su acuerdo con la farmacéutica Pfizer para el escalado en la producción y distribución de la vacuna COVID-19 revalorizó la empresa enormemente.

Las investigaciones llevadas a cabo por Katalin Karikó y Drew Weissman, junto con las de otros investigadores, nos han permitido disponer de las primeras vacunas contra la COVID-19 con una tecnología muy distinta a las vacunas tradicionales, que suelen estar basadas en virus muertos, inactivados o atenuados, o en proteínas recombinantes. La tecnología de ARNm no se detiene en el desarrollo de vacunas contra el coronavirus. Puede ser útil para el desarrollo de vacunas contra otros patógenos, como la gripe, el virus VIH, y para tratamientos más específicos y dirigidos contra diferentes tipos de cáncer. El potencial biomédico de la tecnología ARNm es ciertamente extraordinario. Katalin Karikó espera que la tecnología ARNm se convierta en una plataforma universal para el desarrollo de medicamentos de última generación útiles para tratar enfermedades congénitas, cáncer y muchas otras patologías.
La trayectoria personal y profesional de Katalin Karikó es admirable y ejemplar, y creo que es importante que las nuevas generaciones de investigadores e investigadoras conozcan su compromiso a largo plazo, su tenacidad, perseverancia, inasequible al desaliento, sobreponiéndose a las diferentes trabas y problemas que el sistema científico ponía en su camino. Pero convencida de que su idea podía funcionar (obsesionada con ella, en el sentido positivo del término, como la calificaría Anthony Fauci), dispuesta a demostrar, con su trabajo, humildemente, pero de forma rigurosa, que era posible usar moléculas de ARNm para desarrollar terapias o vacunas. Nunca dudó que estaba haciendo lo correcto y que acabaría funcionando. Katalin Karikó nunca se ha preocupado por la fama, es una investigadora de bata, de poyata, de laboratorio, su entorno natural en el que se siente más cómoda. Y con mensajes nítidos y contundentes: «los investigadores deben poner sus egos a un lado y dedicarse a colaborar para resolver los problemas de este mundo«. Toda una referencia. Y una investigadora que va camino de obtener seguramente uno de los próximos Premios Nobel.


Desconocía totalmente la trayectoria personal de esta fantástica investigadora. Desde luego que es todo un ejemplo a seguir. ¡Gracias por contarnos esta gran historia, Lluis!
Gracias!
Qué entrada tan bien explicada y documentada, aparte de interesante. Además, es de justicia… Enhorabuena.
Gracias!
Muy interesante artículo. Una pregunta: Si alguna vez candidatea, su candidatura sería al Nobel de Química o Medicina?
Es ciertamente imprevisible. Podría ser por cualquiera de las dos disciplinas aunque en su caso quizás estaría más justificado el de Química.
Veremos. Habrá que estar atentos a principios de octubre. Y si no es este año cualquiera de los próximos….
Impresionante artículo, me recuerda a otra mujer incomprendida Rosalyn Franklin.
Gracias por compartirlo.
Excelente artículo Lluis! Un ejemplo esta mujer!
Gracias Fernando!
Un ejemplo del tesón y la buena suerte que necesita un investigador.
Gracias.
Desde que empezó la pandemia de covid, me he interesado en gran medida a tener información sobre la vacuna contra esa enfermedad. Primero leí la historia de los doctores de Turquía que emigraron a Alemania, dueños de BionTech,y sentí tanta admiración por ellos que les seguí sus pasos. Después empecé a leer sobre Katarin Kariko, y obviamente también sentí y siento por ella, la misma o mayor admiración.Creo los tres, o los cuatro porque no hay que dejar por fuera al Doctor Weissman,merecen el premio Nobel. Las vacunas desarrolladas con esa tecnología, han salvado y continuarán salvando millones de vida en el mundo. Demos gracias a todos ellos.
Excelente artículo, Luis… Gracias por divulgar este trabajo.
Muchas gracias Jesús!