
Un médico, un investigador, cuyos trabajos se publican con 40 años de diferencia, un mensajero que entrega un material biológico con retraso y la sempiterna serendipia salvan la vida de una niña recién nacida con un tumor abdominal inoperable.
Estoy seguro que habréis oido muchas veces relatar a científicos lo importante que es la investigación para el avance en nuestro conocimiento sobre el mundo que nos rodea, sobre nuestro cuerpo, sobre las enfermedades que nos afectan y para el desarrollo de terapias que puedan tratarlas o curarlas. Todos tenemos presente ese famoso lema de «sin ciencia no hay futuro«. Por ejemplo, no habríamos tenido vacunas contra la covid-19 si no hubiera sido por la investigación, y esas vacunas, y toda la ciencia que las acompaña, son las que han salvado la vida a millones de personas.
Sin embargo, de vez en cuando, uno se topa con historias que permiten poner nombre y apellidos a todo este proceso. Nombres de pacientes, de médicos e investigadores, que nos recuerdan que detrás de esos grandes postulados que repetimos una y otra vez también se ocultan casos concretos, situaciones cotidianas que afectan a una familia, en la que aparece una terrible enfermedad que la ciencia y la medicina logran combatir con éxito. Un éxito que hay que celebrar. Un éxito que se debe contar.
El jueves pasado, 17 de noviembre, asistimos mi mujer y yo a la presentación de un cortometraje «Vidas (cada segundo cuenta» realizado por el premiado director Nacho Ros y promovido por la Fundación CRIS contra el cáncer. El corto cuenta, en apenas 15 minutos, la vida de un oncólogo pediátrico que se formó entre España, Alemania y EEUU, que aprendió de grandes investigadores que descubrieron los primeros genes que promovían el desarrollo de tumores y que, en su vida profesional, ha tenido que enfrentarse a niños que no ha podido curar y han acabado falleciendo, pero también a otros muchos que sí ha podido tratar, con éxito, y han seguido adelante con sus vidas. Es un cortometraje emocionante de visionado totalmente recomendable.
Hasta aquí podríais pensar que se trata de algo habitual, una historia más de ciencia y medicina con final feliz de las muchas que afortunadamente ocurren a diario y de las cuales habitualmente no nos enteramos. Pero esta es una historia especial, que encadena a un médico con un investigador cuyos respectivos trabajos, separados 40 años, logran salvar la vida de una niña recién nacida con un tumor inoperable. Y esta es la historia que os quiero contar.

El médico de esta historia es Antonio Pérez Martínez, pediatra y oncólogo, actualmente Jefe de Servicio de Hemato-Oncología Pediátrica y Trasplante Hematopoyético, Hospital Universitario La Paz, Madrid. Antonio es, además, director de la Unidad CRIS de Terapias Avanzadas de cáncer infantil y juvenil en el mismo hospital y el investigador principal del Grupo de Investigación Traslacional en Cáncer Infantil, Trasplante Hematopoyético y Terapia Celular del Instituto de Investigación Sanitaria del Hospital La Paz (idiPAZ). Antonio es también uno de los pioneros y promotores en la introducción de las inmunoterapias CAR-T en España.
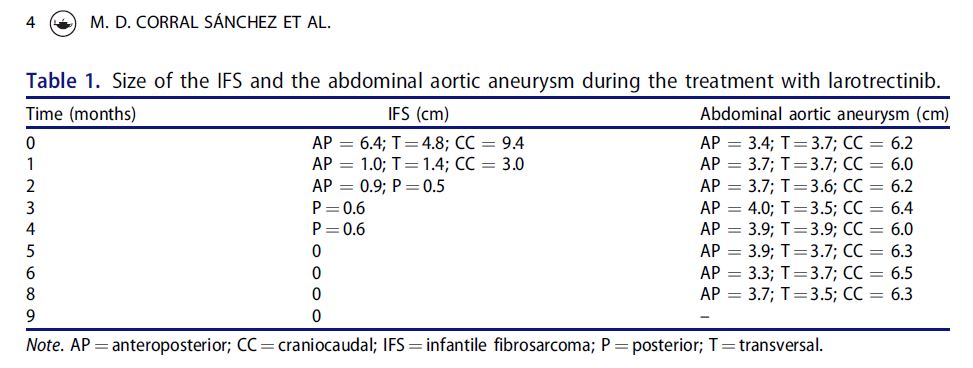
Hace un par de años el equipo de Antonio recibió una paciente, una niña recién nacida (con una edad de un mes) con un tumor abdominal de tamaño considerable, un fibrosarcoma infantil. El tumor era inoperable, por la temprana edad del paciente y por estar asociado a un aneurisma aórtico (un ensanchamiento de la arteria aorta). Este tipo de cáncer es característico en niños de menos de un año de vida y es relativamente infrecuente, dado que representa menos del 1% de todos los tumores infantiles. Al mes y medio se le pudo realizar una biopsia del tumor y los análisis genéticos que siguieron detectaron la «firma molecular» de este cáncer, la alteración genética que muy probablemente lo provocó. Se trataba de una fusión entre dos genes, ETV6-NTRK3, que una traslocación cromosómica entre los cromosomas 12 y 15 había situado, anómalamente, uno al lado del otro. NTRK3 es uno de los tres genes (NTRK1, NTRK2 y NTRK3) que codifican las Tropomiosinas Receptor quinasas (Kinases en inglés) TRKA, TRKB y TRKC, respectivamente. Estos genes regulan varios aspectos del desarrollo neural durante la embriogénesis, entre otras funciones. Pero también pueden convertirse en oncogenes al fusionarse con otros genes en este tipo de traslocaciones. La fusión entre el gen ETV6 y NTRK3, presente en casi el 90% de casos de fibrosarcoma infantil, activa de forma constitutiva la parte que corresponde a la quinasa, lo cual promueve el crecimiento celular descontrolado, el cáncer.

Tras descubrir la firma molecular del fibrosarcoma infantil que presentaba esa niña, Antonio recordó que este oncogén, originalmente llamado trk, resultante de la activación anómala del proto-oncogén NTRK3, había sido descubierto y descrito a principios de los años 80 por un investigador que había sido uno de sus referentes a lo largo de su carrera profesional: Mariano Barbacid, fundador y primer director del Centro Nacional de Investigaciones Oncológicas y actualmente Jefe del Grupo de Oncología Experimental en ese centro.
En efecto, Mariano Barbacid, que dirigió un grupo de investigación en el Laboratorio de Biología Molecular y Celular del Instituto Nacional del Cáncer (NCI) de EE UU, en Bethesda (Maryland) entre 1978 y 1988, acababa de describir en 1982 los primeros oncogenes humanos, los primeros genes (de la familia ras) capaces de causar cáncer.

A finales de 1982, en diciembre, el grupo de Mariano publicó un artículo en la revista Nature donde describía varios de estos nuevos oncogenes, derivados de células tumorales inmortalizadas, o directamente de tumores extirpados a pacientes con diversos tipos de cáncer. Entre ellos estaba un nuevo oncogén sin aparente homología a los oncogenes ras, y que obtuvieron de un tumor sólido de colón (codificado como 2033), al que le dieron el nombre de onc D.
Toda buena historia científica tiene que tener su dosis de serendipia. Y esta no podía ser menos. Mariano Barbacid explicó, durante el coloquio posterior a la presentación del corto «Vidas«, al que había sido invitado, cómo acabaron descubriendo la identidad molecular del oncogen onc D, compartiendo públicamente una historia que había recogido en una revisión reciente de aquellos estudios pioneros. Al parecer, el director del departamento donde estaba inscrito el grupo de Mariano en el NCI, Stuart Aaronson, se dedicaba a establecer líneas celulares a partir de las biopsias de multitud de tumores que le remitían regularmente desde el Memorial Sloan Kettering Cancer Center en New York. Todas las líneas celulares que empiezan con una «A» (de Aaronson), como la línea A2233, también derivada de un tumor de colón y referida en el artículo de 1982, fueron obtenidas por este investigador.
Según explica Mariano Barbacid, en uno de estos envíos entre New York y Washington/Bethesda el mensajero llegó con retraso y se entregó inusualmente un viernes por la tarde, cuando en el departamento habían marchado ya casi todos los investigadores. Todos menos Mariano Barbacid. Mariano se dio cuenta que ese tumor, en fresco, un carcinoma de colón, no iba a poder ser usado para derivar células y no aguantaría hasta el lunes, por lo que, decidió congelarlo, pero antes usó un pequeño fragmento del mismo y decidió utilizarlo como material biológico para obtener ADN de las células tumorales con el cual poder transfectar otras células en el laboratorio, en su búsqueda de nuevos oncogenes. Inicialmente pensó que al usar material fresco, no congelado, podría facilitarle el descubrimiento de otros oncogenes. En realidad los oncogenes seguían ahi, listos para ser descubiertos en el ADN, fuera el tejido de partida fresco o congelado. Y así fue como descubrió el oncogen onc D, en 1982. De forma inesperada. Por serendipia.

No sería hasta 1986 cuando el laboratorio de Mariano descubriría la identidad molecular del oncogén onc D. Se trataba de una fusión anómala entre dos genes truncados, que codificaban para una tropomiosina no muscular y para una proteína tirosina quinasa. Una reorganización somática que estaba en el origen de ese carcinoma de colón, una inversión de un fragmento del cromosoma 1. La fusión aberrante reemplazaba el dominio extracelular de la quinasa por los primeros doscientos y pico aminoácidos de la tropomiosina. Por ello, los investigadores bautizaron al nuevo oncogén como trk (pronunciado «track») por Tropomyosin Receptor Kinase. Posteriormente se descubrieron hasta tres proto-oncogenes de la misma familia: NTRK1, NTRK2 y NTRK3. El primero que se descubrió, por el equipo de Mariano, en 1982, corresponde a NTRK1. En los trabajos citados del laboratorio de Mariano Barbacid aparecen otros dos investigadores españoles igualmente relevantes: Eugenio Santos, director del Centro de Investigación del Cáncer en Salamanca, y Dionisio Martín-Zanca, recientemente fallecido, investigador del IMB (CSIC/USAL) en Salamanca. Este último lideró el trabajo que permitió descubrir el oncogén trk.
Las fusiones aberrantes entre uno de los proto-oncogenes NTRK (el NTRK3) con, por ejemplo con el gen ETV6, como el equipo de Antonio Pérez Martínez había encontrado en las células cancerosas del tumor abdominal de la niña recién nacida, activan de forma incontrolada la proteína quinasa lo cual conduce a un crecimiento celular descontrolado, a la aparición del cáncer. Estas fusiones son relativamente raras, aunque están presentes en diversos tipos de cáncer.
Gracias a la identificación del primer oncogén trk que realizó el equipo de Mariano Barbacid y a otros trabajos posteriores de su grupo y otros grupos que siguieron, resumidos en esta revisión, se pudieron desarrollar inhibidores muy potentes y muy específicos de esta proteína quinasa, para inactivarla y evitar que siguiera sosteniendo el crecimiento de los tumores. Uno de estos inhibidores es Larotrectinib, desarrollado por la empresa LOXO (LOXO-101) funcionó muy bien en los estudios pre-clínicos y los ensayos clínicos posteriores, sin apenas efectos secundarios, con la ventaja adicional de que no se trataba de ninguna quimioterapia y, además, podía administrarse oralmente, en formato de jarabe, por vía oral, lo que lo hacía especialmente indicado para neonatos. La agencia reguladora americana (FDA) designó a este medicamento como terapia innovadora para el tratamiento de tumores sólidos en niños y adultos causados por fusiones de genes NTRK con un tumor sólido avanzado, metastático o no operable y sin opciones terapéuticas alternativas, y finalmente lo aprobó para estas indicaciones terapéuticas en noviembre de 2018 con el nombre comercial de VITRAKVI. En Europa, la Agencia Europea del Medicamento lo aprobó en septiembre de 2019 en idénticas condiciones. Fue el primer inhibidor de proteínas tirosina quinasas en ser autorizado en EE UU y Europa. El medicamento está fabricado por la empresa Bayer AG, que inicialmente firmó un acuerdo de colaboración con la empresa Loxo, para después adquirirla. En España la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) notificó la aprobación condicional en su boletín de julio de 2019, aunque no ha publicado su posicionamiento sobre el uso de este medicamento hasta este mes de mayo de 2022.
Antonio Pérez Martínez conocía la existencia de Larotrectinib, y sabía de su eficacia para tratar tumores sólidos causados por fusiones de genes NTRK, y por eso pensó que este sería el medicamento más adecuado para tratar esa niña recién nacida. Consiguió la autorización de la AEMPS y comenzó a administrar este medicamento experimental por vía oral a la pequeña, dos veces al día, dos meses después de nacer. El medicamento fue proporcionado por Bayer Helathcare, dentro de su «Early Access Program» (programa de acceso temprano).
A los cinco meses el tumor había desaparecido. Y, lo que es mejor todavía, un año después del tratamiento (referido a la fecha de publicación del artículo, en febrero de 2021) no habían aparecido efectos secundarios significativos, más allá de una disminución de glóbulos blancos moderada que se resolvió de forma espontánea.
Mejor aún, Daniela, que así se llama la niña tratada por Antonio, es una de las pacientes a las que se hace referencia en el cortometraje «Vidas» y fue una de las protagonistas de la premiére de esta semana pasada, subiendo con su emocionada madre a entregar una placa conmemorativa al médico que le salvó la vida, a Antonio Pérez Martínez, quien aplicó una terapia desarrollada a partir de la investigación básica realizada por Mariano Barbacid cuarenta años antes.

Y esta es la historia que quería contar. La de un investigador español (Mariano Barbacid) en Bethesda/Washington (EE.UU.) al principio de la década de los 80’s; que se queda a trabajar un viernes por la tarde; que recoge una entrega tardía de material biológico (un tumor, un carcinoma de colón) que envían al responsable del departamento desde Nueva York; que se percata que ya no podrá ser usada para su finalidad inicialmente prevista; que decide usar ese material para seguir descubriendo otros oncogenes; que le sirve en efecto para descubrir un nuevo oncogen, poco frecuente en tumores, al que bautiza como trk. Esa investigación lleva, años después, a una empresa (LOXO) al desarrollo de potentes inhibidores, muy específicos, que inactivan la actividad quinasa desaforada de ese oncogén, causante del cáncer. Esa empresa es adquirida por el gigante farmacéutico BAYER AG, que completa los análisis clínicos, con excelentes resultados, y solicita la aprobación del medicamento en EE.UU. y en Europa, autorización que llega en 2019. De todo ello es testigo un médico e investigador, un oncólogo pediátrico (Antonio Pérez Martínez) con un gran reto que resolver: curar a una niña recién nacida (Daniela) con un tumor abdominal inoperable; un tumor que tiene la firma molecular de los genes de fusión con NTRK; un tumor al que se le puede combatir con los medicamentos recién aprobados; un tumor que remite completamente al administrársele este medicamento como si fuera un jarabe.
Una historia que termina con final feliz y con cuatro personas exultantes: Antonio, Mariano, la madre de Daniela y Daniela.
Muchas gracias y felicidades a Mariano Barbacid por su extraordinaria y fructífera carrera investigadora y por compartir los detalles de esta historia, y a Antonio Pérez Martínez por su perseverancia y compromiso inagotables con la investigación y en su lucha contra el cáncer infantil.
NOTA FINAL: Tras el éxito de este tratamiento con un primer paciente pediátrico el equipo de Antonio ha participado en el tratamiento de un segundo bebé, con dos meses de edad, también con un tumor sólido (esta vez en una pierna), también causado por el oncogén ETV6-NRTK3, y también tratado con el mismo medicamento, Larotrectinib, y con idénticos excelentes resultados: remisión total del tumor a los pocos meses. Hay un ensayo clínico en marcha que sigue evaluando la seguridad y eficacia de este tratamiento y los posibles efectos a largo plazo.


Supongo yo que el inhibidor neutraliza, pero la traslocación anómala siempre estará allí. Por tanto, habrá que administrarle al paciente dicho inhibidor de por vida?
También supongo dependerá del nivel de expresión y de la relevancia de la misma en diferentes momentos del desarrollo.
Realmente una historia emocionante y bella.
No me ha quedado claro:
los protooncogenes NTRK que resultan de la fusión de genes truncados de la tropomiosina y de una tirosina quinasa están presentes en todas nuestras células y regulan el desarrollo neural durante la embriogenesis. Solo eventos moleculares que conducen a una hiperactividad del dominio con actividad tirosina quinasa, como la traslocacion 12-15 que provoca una nueva fusión genética, son capaces de convertir los protooncogenes en oncogenes que inducirán cáncer???
En efecto, es un quimerismo adicional, esa última traslocación, la causante del problema. En este caso la que sitúa adyacentes el NTRK3 con el factor de transcripción ETV6. Y eso lo que produce la patología.