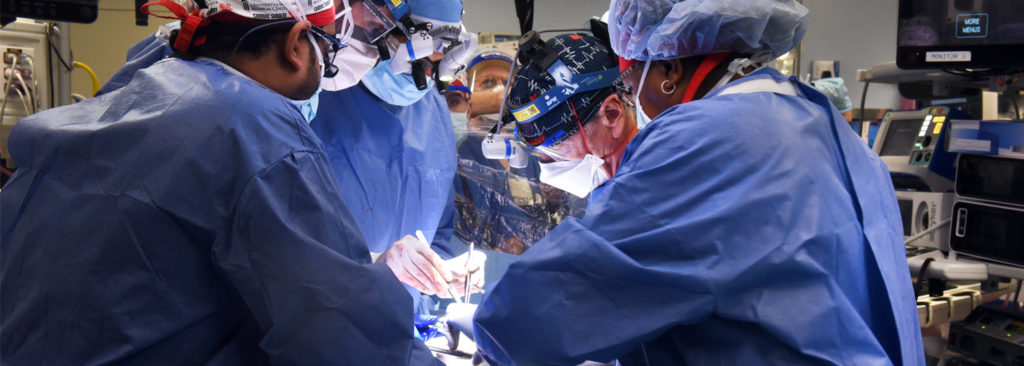
Un equipo de investigadores y cirujanos cardiovasculares de la facultad de Medicina de la Universidad de Maryland, en EE.UU., liderado por los doctores Bartley Griffith y Muhammad Mohiuddin comunicaron al mundo el pasado lunes, 10 de enero de 2022, que habían realizado, con éxito, el primer xenotrasplante de corazón de un cerdo a un ser humano. El paciente, David Bennett, de 57 años, tenía su corazón muy dañado, además de otras patologías y comorbilidades que lo inhabilitaban como candidato para recibir un corazón nuevo, compatible, de otra persona. Al Sr. Bennett le explicaron los riesgos y la novedad del tratamiento que significaba el xenotrasplante, y él consintió libremente, aceptando someterse a un primer trasplante experimental de un corazón animal no humano, de un cerdo modificado genéticamente. La agencia reguladora norteamericana, FDA, autorizó de emergencia este primer xenotrasplante, como uso compasivo, pues el paciente estaba médicamente desahuciado. Han pasado ya unos días y el corazón sigue latiendo con normalidad en el tórax del paciente y no han aparecido signos de rechazo. En definitiva, este primer xenotrasplante, largamente esperado en la comunidad científica y médica desde hacía muchos años, ya es un éxito, sobreviva el tiempo que sobreviva este primer paciente (y que sea el mayor tiempo posible), y lo tenemos que reconocer como tal. Es un avance muy relevante que esperamos tenga continuidad en sucesivos xenotrasplantes que puedan realizarse a partir de ahora.
Pero pongamos este experimento pionero en contexto. Las propuestas de xenotrasplantes, que en definitiva son los trasplantes de células, tejidos u órganos entre animales de distintas especies, llevan muchos años sobre la mesa. En particular se revitalizaron hace más de 30 años, al principio de la década de los 90. Y, desde entonces, ha habido muchos investigadores interesados en encontrar la manera de evitar el rechazo fulminante que se produciría al intentar situar un órgano de un animal dentro del cuerpo de una especie distinta, seguido del rechazo a medio y a largo plazo. Y son ya muchos los experimentos realizados de xenotrasplantes, principalmente de cerdo a primates no humanos, a babuinos. Yo llevo los mismos 30 años explicando en mis charlas y en mis clases a estudiantes los posibles beneficios de los xenotrasplantes y el uso médico de animales transgénicos, cerdos modificados genéticamente, para que sus órganos se pudieran usar en trasplantes a personas. Parecía una idea estupenda, se acumulaban los récords de supervivencia en primates, desde varios meses hasta alrededor de tres años, en algunos casos. Precisamente el equipo de la Universidad de Maryland que ha realizado este exitoso xenotrasplante, liderado por el Dr. Muhammad M. Mohiuddin, de origen pakistaní, era uno de los que había reportado mayor tiempo de supervivencia de babuinos tras ser trasplantados con órganos de cerdos. Pero nos seguía faltando la guinda que culminara todo el proceso. Seguía faltando el experimento definitivo: introducir un órgano de estos cerdos transgénicos en el cuerpo de una persona y que el órgano xenotrasplantado siguiera funcionando con normalidad. Y esto es lo que se ha conseguido ahora.
Joe Carrotta / NYU Langone Health
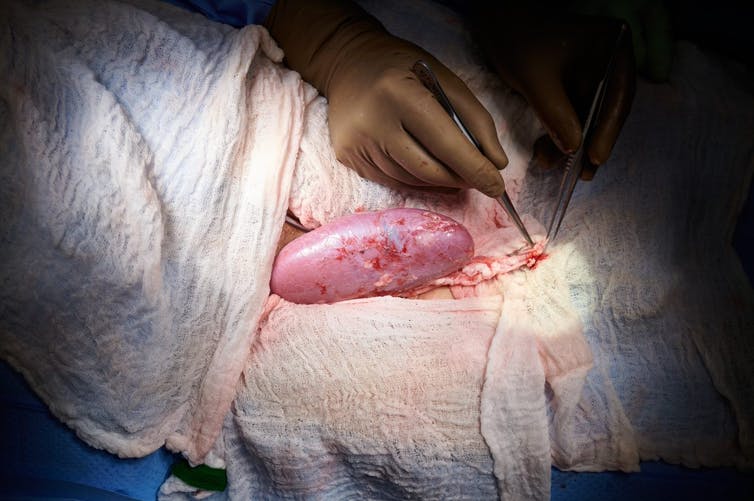
Hay que recordar que, apenas hace unos meses, en septiembre de 2021, conocimos otro experimento pionero de xenotrasplante, realizado en una clínica de New York sobre una paciente en muerte cerebral, declarada en muerte clínica, a quien se le trasplantó un rinón de uno de estos cerdos transgénicos a la pierna, conectándolo a su circulación sanguínea, y comprobando que no ocurría el temido rechazo y que el órgano funcionaba, produciendo orina. Ese experimento, de corta duración (los cirujanos terminaron el experimento a las 54 horas, superadas las primeras 48 horas críticas, tras constatar la ausencia de rechazo) fue un primer paso que ahora se completa con un xenotrasplante realizado sobre una persona viva, que además fue capaz de consentir por sí misma, tras recibir la información del procedimiento experimental al que iba a ser sometido. En el experimento anterior fueron los familiares de la mujer, ya fallecida clínicamente, quienes tuvieron que consentir en su nombre.
Los cerdos son unos animales cuyos órganos tienen un tamaño similar al de los órganos humanos. Por ese motivo, además de por tener una fisiología y un metabolismo también muy parecidos (los cerdos y los humanos nos parecemos más de lo que estamos dispuestos a admitir), por su facilidad de cría y porque no suscitan tantos problemas éticos como generaría el posible uso de primates no humanos para experimentos similares, los cerdos son la especie animal de elección para los xenotrasplantes, y así lo han sido desde que se lanzó la propuesta en los años 90. Aunque es verdad que, genéticamente hablando, los primates estarían más cercanos al hombre que los cerdos, lo cierto es que la cría de primates es mucho más difícil, costosa y requiere mucho más tiempo. Sus órganos no tienen generalmente el tamaño de los de las personas y, además, principalmente, su posible uso suscita enormes dilemas éticos en la sociedad, además de estar muy limitada o prohibida su utilización en experimentación animal en la Unión Europea, por la Directiva 2010/63/UE.
El corazón usado en este primer xenotrasplante deriva de un cerdo transgénico, con múltiples modificaciones genéticas. Hasta diez de esas alteraciones genéticas se han incluido en este animal para esencialmente impedir, limitar o regular el rechazo del órgano animal trasplantado que habitualmente se produciría sin ellas. En este cerdo coinciden cuatro genes porcinos inactivados y seis genes humanos añadidos a su genoma. Entre los genes eliminados destacan dos importantes: uno encaminado a eliminar la proteína que añade unos azúcares específicos a proteínas de la membrana de las células, proteína y azúcares que no tenemos nosotros los humanos (hay tres de estos genes similares, que deben ser inactivados). De esta manera las células porcinas se “parecen” más a las humanas y nuestro sistema inmunitaria las acepta como “propias” y no las rechaza de forma inmediata como “extrañas”. El otro gen es el que codifica el receptor de la hormona del crecimiento, que también se ha inactivado, para impedir que el corazón del cerdo siga creciendo en el tórax del paciente hasta un tamaño que podría llegar a ser un problema, por falta de espacio en la cavidad torácica. Este fue uno de los problemas que surgieron en los xenotrasplantes de cerdo a babuino, y que gracias a estos experimentos iniciales en animales pudo descubrirse y ponersele solución. También se puede inactivar el gen de la hormona del crecimiento en cerdos, para obtener animales de menor tamaño cuyos corazones no presenten problemas de espacio en el tórax de primates, o humanos.
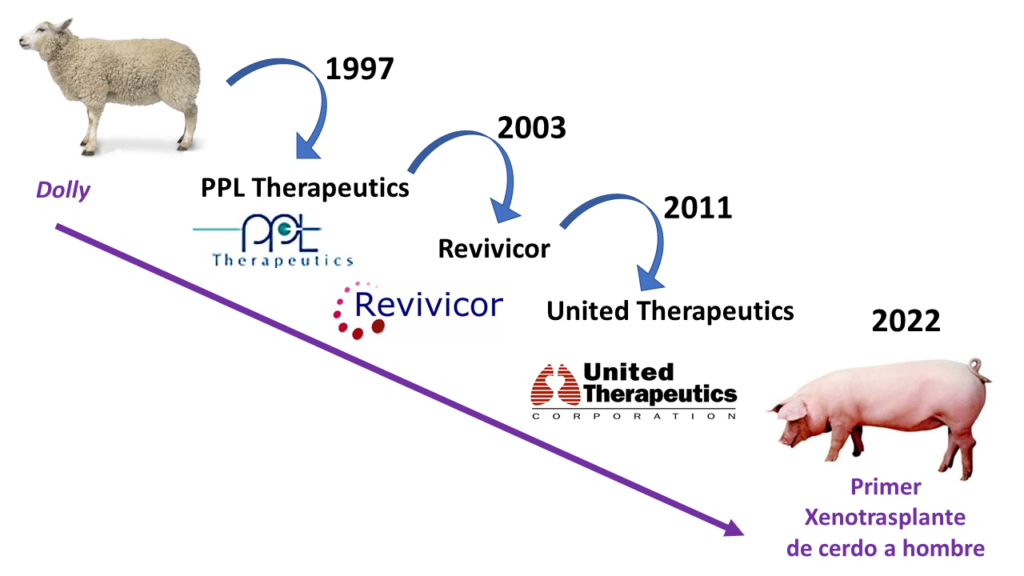
No tenemos, por el momento, información exacta de los genes alterados ni de las tecnologías usadas. Pero es probable que en esta colección de diez alteraciones se incluyan las nueve modificaciones genéticas ya testadas, con éxito, en los experimentos realizados con babuinos: los genes que codifican las tres proteínas que añaden azúcares a las proteínas del exterior de las células; los genes CD46 y CD55, que codifican reguladores de la vía del complemento; los genes de la trombomodulina y del receptor de proteína C en células endoteliales, para controlar la coagulación; el gen anti-inflamatorio de la hemeoxigenasa-1; y el gen CD47 para suprimir respuestas de macrófagos y de células T. Tampoco sabemos si la tecnología CRISPR de edición genética ha sido usada en la generación de estos cerdos, por ejemplo para inactivar alguno de estos genes. Es probable que así sea, aunque muchas de estas mutaciones en el cerdo fueron generadas ya hace años, por procedimientos previos a la edición genética y por ello es igualmente posible que no se haya usado CRISPR en estos cerdos. Ahora bien, lo que sí podemos saber es que la tecnología que ha permitido generar estos cerdos transgénicos es la de clonación. La misma tecnología que descubrimos al conocer la oveja Dolly, el primer mamífero clonado a partir de células adultas. Dolly nació en 1996 y el mundo la descubrió en febrero de 1997, hace 25 años, cuando se publicó su descripción en la revista Nature.

La tecnología de clonación, técnicamente conocida por sus siglas en inglés (SCNT, Somatic Cell Nuclear Transfer), o transferencia nuclear de células somáticas, permite reconstruir embriones unicelulares de animales, previamente vaciados de su material genético, con el núcleo de células en cultivo, por ejemplo fibroblastos embrionarios, en los que se han incorporado cuantas modificaciones genéticas sean necesarias. Los animales resultantes son obtenidos por clonación y, además, transgénicos. Esta es la técnica habitual actual para la generación de cerdos transgénicos y, sin duda, es la técnica usada para generar los cerdos que se han usado para estos primeros xenotrasplantes a humanos.
La oveja Dolly fue generada en 1996 (y dada a conocer en el 1997) en el Instituto Roslin de Edimburgo, en colaboración con la empresa PPL Therapeutics, que finalmente desapareció en 2003. De su desmantelamiento surgió otra empresa, Revivicor, que siguió aplicando la misma tecnología para generar cerdos transgénicos por clonación, hasta que en 2011 fue adquirida por la empresa farmacéutica United Therapeutics, que es la finalmente ha producido los cerdos transgénicos de los cuales se han extraido el rinón usado en New York en septiembre y el corazón usado en Baltimore este mes de enero de 2022. Si alguien se pregunta cuál fue la trascendencia, el legado de Dolly, la respuesta es sencilla ahora. Una oveja que nació en 1996 ha permitido, 26 años después, que un hombre recibiera el corazón de un cerdo en el primer xenotrasplante realizado con éxito. Hay una línea imaginaria que conecta a Dolly con el Sr. David Bennett.
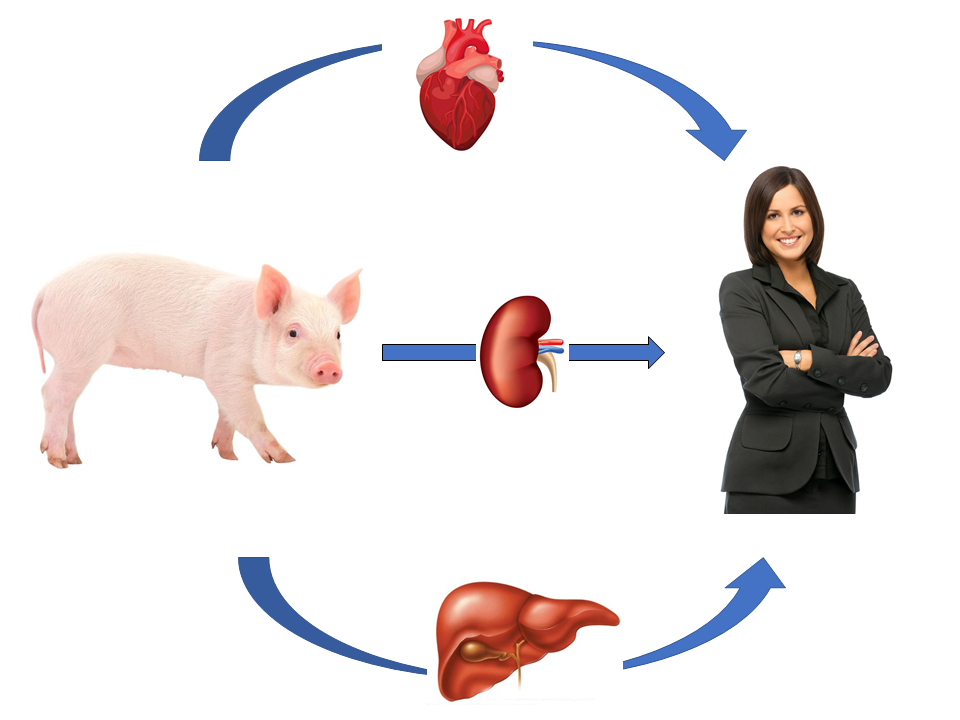
El objetivo de los xenotrasplantes no es que los órganos animales permanezcan en el cuerpo humano de forma indefinida. A pesar de que los órganos provienen de cerdos con múltiples modificaciones genéticas sigue siendo necesario administrar medicamentos inmunosupresores constantemente a las personas trasplantadas, sean con órganos humanos de otras personas inmunocompatibles, y particulamente cuando estos órganos vienen de una especie distinta, como el cerdo. En este experimento se combinó el xenotrasplante con una nueva droga inmunosupresora. Para evitar cualquier rechazo, que desgraciadamente puede aparecer en cualquier momento, terminando la vida útil del órgano trasplantado y exigiendo entonces un nuevo trasplante, para evitar la muerte del paciente. El objetivo de los xenotrasplantes es que estos pacientes puedan ganar tiempo, para que puedan permanecer más tiempo en las listas de espera, hasta poder recibir el órgano humano que, ahora sí, pueda servirles el resto de su vida, en el mejor de los casos.
Desgraciadamente siguen falleciendo pacientes en las listas de espera, al no llegarles a tiempo el órgano que necesitan para sobrevivir. Según los datos en EE.UU. unos 6.000 pacientes fallecen en sus listas de espera, cada año, sin haber podido ser trasplantados. En Europa y, en particular en España, país tradicionalmente lider en donaciones y trasplantes de órganos por millón de habitantes, esas cifras son menores, pero siguen oscilando entre un 15 y un 30% de mortalidad en listas de espera, según los órganos, de acuerdo con las conclusiones realizadas por el proyecto europeo EUDONORGAN, coordinado por la Universidad de Barcelona. Son estos los pacientes a quienes irían principalmente destinados estos procedimientos de xenotrasplantes.
¿Qué peligros, problemas o riesgos están asociados a los xenotrasplantes? ¿Cuáles son los aspectos éticos de los xenotrasplantes?
A finales de los años 90 unos estudios realizados in vitro, poniendo en contacto células porcinas y humanas en cultivo, demostraron que era posible detectar infecciones por retrovirus endógenos porcinos (PERV), presentes en el genoma del cerdo, en las células humanas. Teniendo en cuenta que una persona xenotrasplantada deberá vivir con un régimen de inmunosupresión importante, no parecía el mejor escenario. Se suscitaron muchas dudas sobre el riesgo de que estos virus saltaran la barrera entre especies y causaran daños indeterminados en los pacientes trasplantados. Durante algunos años estos hallazgos provocaron un parón de las investigaciones en xenotrasplantes, y, de facto, se produjo una moratoria. Tras el potencial peligro inicial, pronto se comprobó que no se detectaba la transmisión de estos retrovirus PERV in vivo, en experimentos en los que los órganos de cerdos permanecían largos meses dentro del cuerpo de primates no humanos. Sin embargo, el peligro potencial, al menos en teoría, existía. Y, por ello, en 2017 el laboratorio de George Church obtuvo unos cerdos en los cuales se había inactivado las más de 60 inserciones de retrovirus de su genoma mediante las herramientas CRISPR de edición genética, cerdos que estarían libres de PERV y podrían ser usados con mayor seguridad en xenotrasplantes, pero cerdos a los que habría que añadirles toda la retahila de modificaciones genéticas necesarias para impedir el rechazo por parte del sistema inmunitario humano. En ese trabajo de 2017, y en los anteriores del mismo equipo, participó el investigador español Marc Güell, actualmente en la UPF. Cuento este episodio de la historia reciente de la ciencia en el capítulo 10 de mi libro Editando genes: recorta, pega y colorea. Los cerdos usados por Revivicor seguramente no tienen esta inactivación de PERV, pero las evidencias experimentales no parecen demostrar que estas infecciones puedan producirse in vivo.
El riesgo real de los xenotrasplantes sigue siendo el rechazo, que puede precipitarse en cualquier momento. Esto también ocurre en los trasplantes de órganos entre humanos, y entonces solo cabe programar un nuevo trasplante para substituir el órgano que ha empezado a ser atacado por el sistema inmunitario del receptor hasta dejarlo completamente no funcional. Y por ello las investigaciones de todas las modificaciones genéticas que es necesario incluir, y de las drogas o medicamentos que se pueden usar para reducir ese rechazo siguen siendo el principal caballo de batalla en el campo de los xenotrasplantes.
En cuanto a los dilemas éticos que suscitan estos experimentos, hay quien piensa (los colectivos animalistas) que esta aproximación utilitarista de los animales, que usaríamos para proveernos de órganos de substitución para reemplazar a nuestros órganos dañados no está éticamente justificada. Desde mi punto de vista, si utilizo las herramientas que me proporciona la ética para dilucidar, por un lado, el potencial beneficio de poder salvar una vida humana, y por el otro, el sacrificio de un animal cuya vida se termina para acceder a sus órganos para ser trasplantados al paciente que lo necesita, sigo considerando que estaría éticamente justificado el experimento, pues los beneficios potenciales superarían en mucho el daño causado. Hay que recordar que en países como el nuestro el número de cerdos destinados a consumo y engorde se acerca al de la población en general. Y se sacrifican más millones de cerdos anualmente que personas vivimos en España, cerdos que «usamos» para nuestra alimentación. En el caso de los xenotrasplantes se trata de un reducidísimo grupo de animales, genéticamente sofisticados y mantenidos en unas condiciones óptimas, que solamente han sido producidos para obtener estos órganos cuyo destino son los xenotrasplantes.
El verdadero problema ético de los xenotrasplantes es el de la accesibilidad de los pacientes que lo necesiten a estas tecnologías tan sofisticadas y avanzadas. El cuarto principio de la bioética nos habla de justicia, y nos recuerda que todos los tratamientos que podamos proponer o desarrollar deben poder ser accesibles a toda aquella persona que lo necesite. No solamente a aquellos que puedan costearlo. El coste de estos procedimientos es pues una de las principales barreras éticas que habrá que salvar para conseguir que estas técnicas, complicadas, que requieren la colaboración de múltiples equipos de veterinarios, investigadores y médicos, puedan diseminarse, universalizarse y, esperemos, más pronto que tarde, estar al alcance y disponibles para todo aquel que las pueda necesitar.
De cualquiera de las maneras creo importante terminar este artículo resaltando que estamos de celebración. Hay que aplaudir el éxito científico y médico de este equipo de la Universidad de Maryland. Tras más de 30 años de investigación básica y preclínica una persona sobrevive con un corazón de cerdo, en substitución del suyo dañado. Esto es lo relevante. Los xenotrasplantes no solamente están de vuelta, como comentaba hace unos meses. Han venido para quedarse. Ahora esperemos que se establezcan ensayos clínicos en los que puedan enrolarse un número significativo de pacientes para poder evaluar, con mayor claridad, la seguridad y la eficacia de los xenotrasplantes. Empieza otra etapa. Y será todavía más apasionante.
Una versión de este artículo ha sido republicada en The Conversation el 14 de enero de 2022.


Muchas gracias por el artículo.
Tiempos apasionantes !
Muchas gracias por tus artículos, a mis alumnos les gustan mucho y me ayudan para que entiendan las aplicaciones presentes y futuras de la Biotecnología.
Un saludo
Muchas gracias Benito, también por usar este material en la clase con tus alumnos.