
La transparencia es fundamental en ciencia y tiene que servir para hablar, con todos los detalles posibles, de los éxitos que se logren. Pero también debe servir para hablar de los fracasos, errores o fiascos, como el que hemos conocido en las últimas semanas, vinculado a las famosas vacas sin cuernos creadas usando la revolucionaria tecnología de edición genética por Recombinetics, una empresa norteamericana de Minnesota, e incluidas en una publicación científica en 2016. Escojo este gran fiasco en edición genética, inesperado, que sorprendentemente no parece haber sido detectado por demasiados medios de comunicación, pero sí recogido por el MIT Technology Review y otros, para abrir este nuevo blog sobre Gen-Ética en el espacio Naukas, en el que pretendo ir comentando temas de genética y de ética, dos disciplinas con las que trabajo y que me apasionan. La ciencia avanza a través de éxitos y fracasos, aciertos y errores. Nuestra credibilidad como investigadores depende por igual de cómo compartimos nuestros logros, y también nuestras meteduras de pata. En definitiva, la ciencia la hacen las personas, y estas, naturalmente, pueden equivocarse. No hay nada más humano que errar. Cuando esto ocurre hay que afrontar el error, explicarlo y aprender del mismo, para intentar evitar cometer errores similares en el futuro. No hay otro camino.
Las terneras Buri y Spotigy, llamadas así por sus creadores en la empresa Recombinetics, nacieron en 2015 y fueron las primeras vacas de la raza Holstein (las típicas vacas lecheras blancas y negras) que no desarrollaron cuernos, evitando así tener que ser descornadas (serrando los cuernos) o desmochadas (cauterizando el esbozo de cuerno cuando empieza a crecer), procedimientos muy agresivos y nada agradables para los animales. Ni para los granjeros. Más de 13 millones de vacas son descornadas anualmente en EEUU, según indicaron los autores en el estudio en el que presentaron estas primeras terneras editadas en sociedad. Recombinetics encontró esta solución innovadora y elegante, usando la tecnología de edición genética. Decidieron incorporar en el genoma de las vacas de la raza Holstein (con cuernos, HORNED) una variante genética del genoma de las vacas de la raza Angus (vacas de color negro, apreciadas por su carne), portadoras de la mutación dominante POLLED, que provoca que nunca desarrollen cuernos, mediante la tecnología de recortar y pegar a nivel molecular.
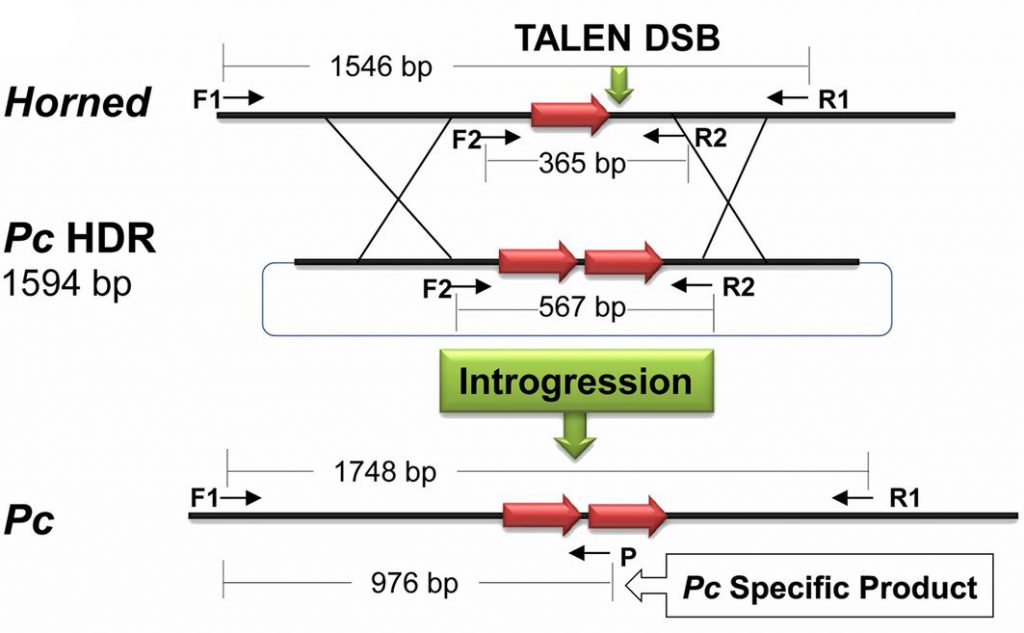
La mutación POLLED (en realidad la variante Celta de la mutación POLLED, de ahí que se la denomine también Pc) en realidad es una duplicación de 212 nucleótidos (las bases A, G, T y C, que forman los genomas de la vaca, y también el nuestro) que substituye a 10 nucleótidos originales en el locus intacto (variante HORNED). En la figura adjunta, derivada de la publicación de Tan y colaboradores en la revista PNAS en 2013, los investigadores de Recombinetics usaron las herramientas TALEN, anteriores a las CRISPR, para duplicar una secuencia (flecha roja) eliminando 10 letras en el proceso. De ahí que la secuencia de ADN original de HORNED (una flecha roja) se convierta en POLLED (dos flechas rojas), y el fragmento de ADN analítico pase de 365 a 567 letras de longitud (365-10 = 355 + 212 = 567). Las herramientas TALEN utilizadas, en esencia, realizan la misma función que las CRISPR: cortan el ADN de forma precisa en el lugar indicado del genoma. Aunque lo hace de forma distinta a las CRISPR. En el caso de las TALEN (acrónimo en inglés de Transcription Activator-Like Effector Nuclease) quien dirige la nucleasa a cortar una secuencia de ADN no es una pequeña molécula de ARN, como las CRISPR, sino una proteína TALE, derivada de una bacteria que infecta a las plantas y toma el control de sus células, unida a una nucleasa (N), que es quien acaba cortando el ADN. Las proteínas TALE pueden construirse en el laboratorio y, siguiendo un código deducido tras analizar muchas de ellas en la naturaleza, se pueden «programar» para que encuentren una secuencia de ADN determinada.
Recombinetics revolucionó las aplicaciones de la edición genética con este experimento, realizado sobre células (fibroblastos) obtenidas de toros de la raza Holstein. Limpiamente habían conseguido convertir el locus HORNED en POLLED. Los fibroblastos editados genéticamente resultantes los usaron para derivar toros Holstein que, ahora sí, nunca más desarrollarían cuernos. Para ello utilizaron la técnica de SCNT (transferencia nuclear de células somáticas), también conocida como clonación (que descubrimos con el nacimiento de la oveja Dolly) para reconstruir embriones de toro con núcleos de estas células Hosltein editadas. Y nacieron dos terneritas: Buri y Spotigy, que se describieron en 2016. Dos magníficos animales de la raza lechera Holstein… pero sin cuernos. Naturalmente los investigadores usaron fibroblastos de toro para poder obtener animales macho, de los cuales derivar esperma para rápidamente fecundar muchas vacas y transmitir la nueva variante de forma eficaz en la población bovina. Si los investigadores hubieran querido movilizar la mutación POLLED desde Angus a Holstein mediante cruces tradicionales habrían tardado muchos años y muchas generaciones, hasta conseguir una vaca que siguiera reteniendo la producción lechera de las Holstein pero sin cuernos, eliminando todo el resto del genoma de Angus que no necesitaban. Durante la meiosis, necesaria para producir los gametos en cada generación, se habrían mezclado los genomas de Holstein y Angus, produciendo vacas de características intermedias que no serían de interés. Este es el eterno problema de la mejora genética tradicional, que ya sabemos que no es una solución práctica. La edición genética permitía solucionar, de forma limpia, el problema. Y en una sola generación. O al menos eso pensaban. Eso pensamos todos. Yo mismo dediqué a estas asombrosas vacas sin cuernos uno de los capítulos de mi libro «Editando genes: recorta, pega y colorea» (NextDoor Publishers, 2018), y las he usado profusamente como ejemplo en muchas de las charlas que he impartido sobre edición genética.

Recombinetics presentó las vacas Holstein editadas, sin cuernos, en multitud de reuniones científicas, cosechando admiración y aplausos. Y se enfrentó a la poderosa FDA, la agencia norteamericana encargada de la seguridad en alimentos y medicinas, que proponía considerar el ADN editado como un «nuevo medicamento» y, por lo tanto, pretendía solicitar multitud de pruebas de seguridad y toxicidad, como si se trataran de vacas transgénicas, como si fueran animales modificados genéticamente. Una y otra vez Recombinetics repitió que lo único que habían hecho con ayuda de las herramientas TALEN de edición genética era substituir una variante genética por otra, de forma precisa, de forma limpia, sin añadir ni introducir ningún otro gen o fragmento de ADN en el genoma de las vacas editadas resultantes. Y que las dos variantes existían ya en la naturaleza, que no habían inventado nada. De hecho, en abierto desacuerdo con la FDA, lo cierto es que Recombinetics nunca solicitó formalmente la aprobación de estos animales en EEUU.
Pero no era así. Las vacas editadas sí eran transgénicas. Gracias a unos análisis fortuitos, realizados en la FDA y depositados en el servidor de artículos compartidos bioRxiv, usando la información genética de los genomas editados de estas terneras Holstein editadas (información que los investigadores de Recombinetics habían puesto a disposición de cualquier otro investigador interesado), acabamos de conocer que el genoma de las vacas editadas (en particular el genoma de Buri, el que se analizó) no está tan intacto como pensábamos. Un gran fiasco. Una decepción y un gran problema para Recombinetics, y para todo el sector biotecnológico.
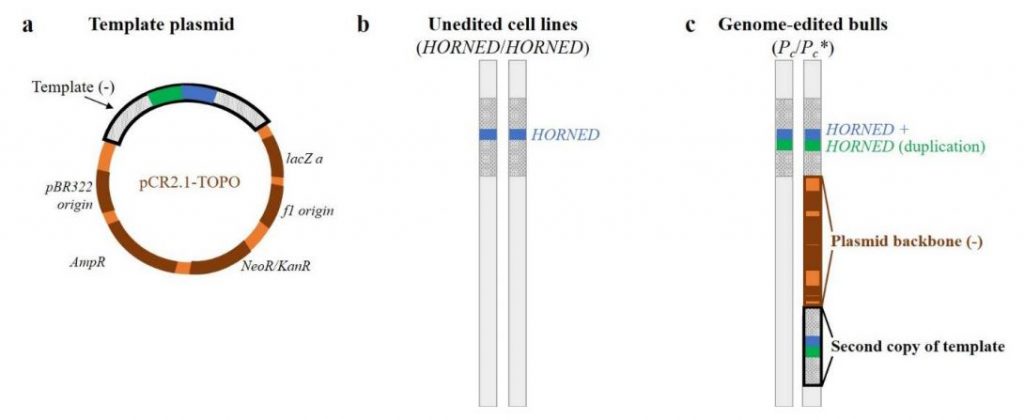
¿Qué había pasado? Lo ocurrido lo explican estupendamente Norris y otros colaboradores de la FDA en su estudio. Las herramientas de edición genética se pueden introducir en los embriones y en las células en diferentes formatos. Lo más sencillo, lo que primero se desarrolló, fue el uso de plásmidos, moléculas de ADN circulares fáciles de crecer en bacterias y fáciles de introducir en células mediante procedimientos de transfección. También se pueden usar molécular de ARN, portadoras de la información, o, en el caso de las nucleasas, directamente proteína recombinante. Los investigadores de Recombinetics usaron ARN para introducir la región codificante para las herramientas TALEN y un plásmido para proporcionar el ADN molde que contenía la duplicación que esperaban introducir, por recombinación homóloga, en el locus HORNED para convertirlo en la variante mutante POLLED. Se esperaba que la molécula de ARN de TALEN se tradujera (de ARN a proteína), y que el plásmido con el ADN molde se usara solamente para aportar la secuencia a usar en la corrección, en el pegado del corte producido por la TALEN. Y nada más. Los plásmidos portadores del ADN molde debían haber desaparecido tras el evento de edición, no debían haberse insertado. Pero se insertaron en el genoma de las células editadas.
El uso de plásmidos de ADN para introducir herramientas de edición genética ZFN, TALEN o CRISPR, o de ADN molde, en plantas es habitual. Es el procedimiento normal. Y no se asume que los plásmidos no se vayan a integrar. De hecho frecuentemente se integran en el genoma de las plantas editadas resultantes. Y es entonces labor del investigador el proceder a segregar en las siguientes generaciones el gen editado (que es lo que interesa) de cualquier resto de plásmido que hubiera podido integrarse. Hasta conseguir semillas y plantas que solamente tengan la variante editada, y ninguna otra inserción ni modificación en el genoma. Claro, el obtener sucesivas generaciones es relativamente sencillo de obtener en plantas. Es mucho más costoso y lento en animales, y requiere mucho más tiempo, especialmente con animales de granja, como las vacas, que habitualmente no suelen ponerse a cruzar hasta pasados 15 meses tras su nacimiento.
En animales se suelen evitar, en lo posible, los reactivos ADN, precisamente por su riesgo de integrarse en el genoma. Se suelen utilizar construcciones directamente ya de ARN o de proteínas recombinantes, para las nucleasas, y moléculas de cadena sencilla (monocatenarias) de ADN para aportar el molde que se pretende usar en la edición. Ahora bien, en células animales la transfección de ARN, proteínas o ADN de cadena sencilla es técnicamente complicada. Por eso muchos laboratorios siguen optando por transfectar plásmidos de ADN. Exactamente como hicieron los investigadores de Recombinetics. Lo que resulta sorprendente es que, más allá de confirmar la presencia de la duplicación deseada, y a pesar de contar con la secuenciación genómica completa de los clones de fibroblastos editados (información que ha sido utilizada por la FDA años después para encontrar el error) no se dedicaran a revisar, cuidadosamente, si se habían introducido secuencias del plásmido en el proceso de edición. Deberían haber revisado diversos clones editados para acabar seleccionando aquel que no tuviera inserciones no deseadas. Por el contrario optaron por confirmar la presencia del alelo editado, la no existencia de otras secuencias parecidas modificadas (off-targets), y no revisaron ni se percataron de la presencia de una copia entera del plásmidos y de otra duplicación del ADN molde que se habían insertado a continuación en el genoma, en uno de los dos alelos. Un fallo importante del control de calidad que ahora asumen los responsables de Acceligen, la empresa derivada de Recombinetics que se ha hecho responsable de estos animales.
¿Qué puede suceder debido a la inserción de estas secuencias plasmídicas? Probablemente nada. Pero es preocupante que se introduzcan genes de bacterias, en especial de resistencia a antibióticos (Ampicilina/Kanamicina) usados en los procesos de selección en bacterias, y aunque improbable, no es imposible que estos genes de resistencia pudieran saltar a las bacterias que viven en el interior del cuerpo de las vacas editadas. Sabemos que la presencia de genes procariotas insertados en genomas eucariotas suele producir alteración y hasta el silenciamiento de los genes eucariotas colindantes. En cualquier caso, estas secuencias no deberían haber llegado nunca a formar parte del genoma de la vaca. Se deberían haber detectado estos clones erróneamente editados y haber sido descartados. En su lugar, se deberían haber seleccionado clones de fibroblastos editados que portaran solamente la edición planeada, y nada más. Como se puede apreciar en los resultados de los investigadores de la FDA, solamente uno de los alelos está erróneamente editado. Así pues, solamente la mitad de la descendencia del toro Buri (Spotigy fue sacrificado para ser analizado) transmitirá el alelo correcto POLLED a su descendencia. Pero ya será inevitable admitir que para su generación se habrían generado animales transgénicos, lo cual, desde el punto de vista regulatorio, reviste una extraordinaria importancia (son animales transgénicos, genéticamente modificados, bajo todos los puntos de vista) y echa por tierra la precisión y limpieza del proceso, autoproclamadas por la empresa. De hecho nadie cree que la empresa vaya a solicitar ahora aprobación por parte de la FDA. Y al aparecer una solicitud de aprobación similar para estos animales en Brasil ya ha sido denegada.
En Europa, a finales de julio de 2018, el Tribunal de Justicia de la Unión Europea dictaminó que los organismos editados genéticamente debían ser considerados transgénicos y, como tales, estar sujetos a todas las pruebas y tests de toxicidad y seguridad que se exigen actualmente a cualquier organismo modificado genéticamente (y que, de facto, han bloqueado el desarrollo de organismos transgénicos en Europa). Fuimos muchos quienes nos revelamos contra esa decisión, sin fundamento científico, al considerar que la edición genética no era equivalente a una transgénesis, al no introducir nuevas secuencias de otros organismos, sino variantes ya existentes en la naturaleza. Pero claro, para ello debe cumplirse que la planta o el animal editado no sea transgénico por otros motivos. La mayoría de plantas editadas son transitoriamente transgénicas durante el proceso de edición, hasta que se eliminan las construcciones integradas con las herramientas de edición, por segregación, y se seleccionan solamente aquellas plantas que tienen la edición deseada y nada más. Estas últimas no deberían estar sujetas a la misma regulación como otras plantas transgénicas, aunque desde la Unión Europea se argumenta (de forma parecida a la FDA) que debido a que se ha usado transgénesis durante el proceso de edición estas deberán estar sujetas a las mismas pruebas y verificaciones como el resto de plantas transgénicas (a pesar que no quede ni rastro de los transgenes en las plantas finalmente editadas).
Los aproximadamente 17 descendientes de Buri se distribuyeron entre Minnesota, California y Australia, en diferentes centros colaboradores de Recombinetics. Nadie se percató de la presencia inesperada de estas secuencias indeseadas de ADN bacteriano en la mitad de los hijos de Buri (la otra mitad habría heredado la mutación POLLED limpia). Según indica el artículo de MIT Technology Review la mayoría de animales que quedaban en California ya han sido incinerados.
Un triste final para un experimento de edición genética en animales que se presentó como paradigmático y ejemplar. Y una nueva lección para aprender (o para reforzar nuestras convicciones) para todos los científicos que nos dedicamos a la edición genética. La de revisar a conciencia el genoma de los organismos editados antes de concluir que solamente contienen las alteraciones planeadas.
ACTUALIZACIÓN (13 de octubre de 2019)___________________________________
A principios de octubre ha aparecido una nueva información de este caso que merece la actualización de este artículo, para que la información que se incluye en él esté actualizada y sea veraz y rigurosa. Tras la identificación de secuencias de plásmido bacteriano en el ADN, realizada por investigadores de la FDA en los terneros editados por Recombinetics, lo que no sabíamos es que Buri, el animal que no había sido sacrificado y había sido enviado a la Universidad de California en Davis, se había utilizado para obtener semen y así poder inseminar diversas vacas y analizar cómo se comportaba el alelo editado POLLED en la progenie. Este es un trabajo que, sistemática y discretamente, estaba llevando a cabo la investigadora Alison van Eenennaam, desde finales de 2015, una historia que cuenta estupendamente Megan Molteni en la revista Wired. Este trabajo finalmente vió la luz en forma de publicación en la revista Nature Biotechnology, el día 7 de octubre de 2019 (en formato open access).

Alison y su equipo inseminaron vacas con el semen de Buri y obtuvieron seis preñeces, que dieron lugar al nacimiento de cinco terneros y una ternera, en septiembre de 2017. En paralelo, obtuvieron terneras control derivadas de vacas de la raza Hereford, con cuernos, que nacieron poco después. De los seis animales hijos de Buri, todos ellos presentaron el fenotipo POLLED (la mutación es dominante, heredando cualquiera de los dos alelos editados de Buri es suficiente para que el animal no desarrolle cuernos). Cuatro de estos animales habían heredado el alelo editado que incluía la duplicación y el plásmido. Los otros dos habían heredado el alelo editado limpio.
¿Cuáles eran las diferencias entre los animales que habían heredado el plásmido frente a los animales que no habían heredado el plásmido? ¿Cuáles fueron las consecuencias en los animales que eran portadores de secuencias de ADN de procariotas que no deberían haber estado allí? Pues lo cierto es que Alison van Eenennaam y su equipo de la UC Davis no encontraron diferencias entre los dos tipos de animales. Ni entre estos animales y los animales, con cuernos, utilizados como control. Los animales estudiados, todos ellos, se comportaron como cualquier otro toro o vaca de la raza utilizada en el experimento. No se encontraron alteraciones genómicas adicionales en el ADN de los animales editados. En otras palabras: nunca debería haberse permitido el nacimiento de animales portadores de secuencias plasmídicas en su genoma, pero, una vez producido este error, que la empresa no detectó en su momento, lo cierto es que la presencia de este fragmento de ADN bacteriano en el genoma de estas vacas no tiene mayores consecuencias, ni se observan alteraciones que puedan correlacionarse con esta inesperada inserción de ADN foráneo.
En el estudio se reflexiona si es razonable el conjunto de análisis que la FDA exige abordar antes de poder comercializar estos animales editados o sus descendientes. No parece que los potenciales riesgos imaginados y asociados a estas tecnologías estén justificados tras este artículo pormenorizado, que demuestra, en un caso concreto, la inexistencia de dichos riesgos. Los análisis de riesgos y toxicidad que se le exigen a cualquier empresa representan una inversión considerable, tanto en tiempo como en dinero, que muy pocas empresas pueden permitirse. Este estudio, que ha tardado unos 4 años en completarse, para poder acumular datos fenotípicos de descendientes de la primera generación, debido, entre otros parámetros, al largo tiempo de gestación (alrededor de 9 meses) y a la espera para poder tomar datos representativos de animales adultos (de unos 15 meses de edad), debería servir para que las autoridades recapacitaran y acordaran permitir que los potenciales beneficios de estas técnicas de edición genética, en bienestar animal (como es este caso de vacas que no tienen ya que descornarse) o en producción, pudieran llegar a los consumidores. Veremos si esto se consigue, aunque yo, como la mayoría de mis colegas, somos pesimistas en relación a un posible cambio regulador tanto en la FDA como en la Unión Europea, en los cuales sigue imperando un mal entendido principio de precaución.
Finalmente, a principios de este mes, la empresa Recombinetics publicó un comunicado de prensa en el que reconoce que debió haber investigado y revisado la presencia del plásmido en las células editadas que posteriormente usó para obtener los animales editados sin cuernos, POLLED. La compañía, conocedora del impacto de este error, lamenta las consecuencias que el mismo pueda tener para el sector biotecnológico. E informan que los próximos desarrollos POLLED estarán libres de plásmidos, serán portadores de la mutación conocida en bovinos y estarán certificados por veterinarios para garantizar su salud y la presencia de la característica falta de cuernos. Para terminar, la empresa incluye un párrafo obvio pero igualmente importante. Dado que Buri portaba dos alelos, uno editado limpiamente y otro con el plásmido, aproximadamente la mitad de sus descendientes estaría libre de inserciones de ADN no deseadas y podría utilizarse para la comercialización. Este sería el deseo de la empresa. La FDA (y la Unión Europea) argumentarían, por el contrario, que dado que son hijos de una toro que era, desde todos los puntos de vista, transgénico, deberán ser sometidos a todo el dossier de análisis que todo organismo genéticamente modificado debe superar antes de poder ser aprobado, estén justificados científicamente o no esos análisis. El estudio de la UC Davis nos dice claramente que todos esos riesgos y análisis no están justificados científicamente.
Y de nuevo estamos ante una tecnología que podría ser muy útil pero que puede tardar en llegar a los consumidores. Evidentemente errores como el cometido por Recombinetics no ayudan en nada al sector. Pero hay que aprender de los errores. Para evitar cometerlos en el futuro. Y hay que analizar sus posibles consecuencias, como ha hecho de forma magistral el equipo de Alison van Eenennaam, para poder utilizar evidencias científicas, y no temores apriorísticos infundados, a la hora de tomar decisiones de caracter regulatorio.


Gran artículo y enhorabuena por la apertura del blog. Me quedo con la importancia de rectificar en ciencia y de asumir los errores que, como dices, son inevitables.
Muchas gracias. En efecto, es inevitable cometer errores. Pero cuando se encuentran hay que explicarlos, compartirlos y tratar de evitarlos, para no volver a cometerlos. Sera duro para esta empresa pero han empezado bien, asumiéndolo y comentando lo obvio, que no se dieron cuenta, que se les pasó revisar este aspecto tan relevante. Te aseguro que no les va a volver a pasar. Ni a ellos ni a otras empresas del sector.
Muchas gracias, todos nos equivocamos. Eso no lo podemos evitar. Pero cómo reaccionamos ante los errores es lo realmente importante. En Ciencia la transparencia implica compartir éxitos y fracasos. De todo se aprende.
Toda esta histeria regulatoria antitransgénicos es de lo más estúpido que he visto en muchos años. Continuamente se crean nuevas razas por selección tradicional, con cientos o miles de genes modificados con respecto a la raza o razas originales, y con total desconocimiento de cuáles son y cómo se han modificado, y nadie les exige los draconianos controles que les piden a los transgénicos, en los que se modifican poquísimos genes y que se sabe cuáles son y cómo se han modificado.
En definitiva, más que un fiasco de la edición genética, es un fiasco, y gordísimo, de la política.
Pues también tienes razón Antonio. Personalmente me molesta/sorprende más que no se haya detectado este error a tiempo (que podría haberse detectado) más que finalmente haya llegado a las vacas editadas. Como digo en el artículo, desde un punto de vista científico las consecuencias de este error probablemente sean nulas o insignificantes. Esencialmente en dos generaciones tienen el problema resuelto, seleccionando solo aquellos descendientes que hayan heredado el alelo mutante limpio. Pero desde el punto de vista regulatorio es un gran fiasco, especialmente por toda la historia previa de la compañía, que insistió ante la FDA de la limpieza y precisión de la edición realizada. Ahí está el problema, en mi humilde opinión.
Un artículo muy interesante. Yo creo que estos intentos ponen en evidencia michas cosas. Por una parte la sin duda necesaria escrupulosidad de los protocolos para evitar caer en errores previsibles y sobre todo no dar lugar al potenciamiento de restricciones de índole política y popular. Y por otra parte el increible potencial de estas líneas de investigación.
Muchas gracias J.R., de acuerdo también con tu acertado resumen.
gracias por el artículo, por seguir comprometido con la divulgación ahora desde Gen-Etica, y por darnos a conocer a Naukas
Muchas gracias Eduardo!
Muchas gracias Lluis por iniciar este blog. Para mi tus artículos sueltos en Naukas son la mejor fuente de información que he encontrado para formarme una opinión sobre modificación genética, así que estamos de enhorabuena con el paso que has dado.
Te honra haber empezado precisamente con este artículo. Después de leerlo, opino que son necesarios controles sobre los organismos editados, entiendo que no es necesario un control de seguridad y de toxicidad si resulta posible comprobar que no hay transgenesis. Los promotores tienen un sesgo de confirmación muy grande, ya que es su trabajo dar resultados, como queda patente en este caso. Me parece que la FDA ha hecho un gran trabajo.
Muchas gracias nuevamente, por haberme dado a conocer y entender todo el asunto.
Muchas gracias César, te agradezco tus comentarios. Entiendo que puede ser difícil a veces comprender todo lo que ocurre alrededor de los organismos modificados genéticamente. Desde este blog intentaré aportar mi granito de arena para facilitar esta comprensión y promover el debate con argumentos y evidencias científicas.
Lluís
Extraordinario articulo , un gozo leerte y de acuerdo contigo ; ante todo el rigor científico debe imperar no solamente en la edición genética sino en toda la experimentación.
Gracias Vianney!. Qué ilusión reencontrarte también por aquí. En efecto, rigor y transparencia ante todo!
un fuerte abrazo!
En los casos de edición genética mediante transgénesis, debería existir la obligación legal de realizar análisis que demuestren que no han sido creados organismos transgénicos. La aplicación de dicha ley no solo evitaría comportamientos gravemente negligentes como el de la empresa Recombinetics, sino que tanto la FDA como sus homólogos de la Unión Europea se verían obligados a abandonar su irracional equiparación entre organismo editado y organismo transgénico.
La edición genética que implica transgénesis (introducción de un nuevo fragmento de gen o un nuevo gen en un organismo) de hecho ya está cubierta por la misma directiva europea de 2001 tras la sentencia del Tribunal de Justicia de la Unión Europea de julio de 2018.Y el completo dossier de experimentos y test que se solicita incluye lo que comentas. Gracias por tu comentario!
Enhorabuena por el nuevo blog; genética y ética -el logotipo del nombre, muy bueno- son reflexiones imprescindibles en los nuevos avances de ingeniería genética y biomedicina.
Y un magnífico artículo para comenzar; exponiendo un error, explicarlo fenomenalmente y hacernos entender todos los cuidados que experimentador y técnicas deben aplicar.
Muchas gracias Marisa, reitero contigo lo importante que sois el colectivo de profesores de institutos de enseñanza secundaria para trasladar cómo progresa de verdad la ciencia a nuestros jóvenes, con sus éxitos, y también con sus fracasos. Muchas gracias por tus amables palabras. Un abrazo!
Le he escuchado en A Hombros de Gigantes hablar sobre este asunto, haciendo un símil con la construcción de un armario en el que se han olvidado las herramientas dentro, es decir parte de las herramientas de edición genética que hacen que los animales resultantes sean transgénicos.
Quería preguntarle ¿y no sería más sencillo sacrificar a estos animales y empezar de nuevo a hacer el armario, pero esta vez con cuidado de no dejarse las herramientas dentro? Por lo que dice, monitorizarlos a ellos y a su descendencia puede ser muy costoso, aparte de que pudiera implicar un remoto riesgo por esas cadenas de genes no deseadas.
Muchas gracias por el artículo. Muy interesante.
Gracias JM. Efectivamente, hay dos soluciones. Por un lado se podrían cruzar estas vacas y esperar que en aproximadamente la mitad de su descendencia heredarán la variante «sin cuernos» limpia, sin el plásmido integrado, y seguir a partir de aquí, descartando las demás. Ahora bien, dado que provendrían de animales transgénicos ni en US, por la FDA, ni en la EU, por la Directiva 2001/18 podrían evitar el análisis de riesgos y toxicidades.
Una alternativa es la que dices, que intuyo es la que seguirá la empresa. Empezar de nuevo, a partir de nuevas células editadas que tenga la mutación «sin cuernos» pero que no tengan el plásmido. Y derivar nuevas vacas de estas células editadas. Parece sencillo pero no lo es. Son años de trabajo. Veremos que ruta toman. Estemos atentos.
La ampicilina no es el antibiótico que ya no funciona?
La ampicilina es un antibiótico que sigue siendo útil, a no ser que la bacteria tenga precisamente el gen de resistencia a ampicilina, que es el que está codificado en este plásmido. De ahí el problema de habérselo dejado dentro, olvidado.