
Con la edición genética con las herramientas CRISPR corremos el riesgo de reducir su impacto a las aplicaciones en biomedicina, las que pueden trasladarse a la clínica para aliviar, tratar o curar pacientes enfermos con patologías incurables de base genético. Sin duda esta es una finalidad que suscita las mayores expectativas y genera montones de noticias, aunque los éxitos sean todavía limitados. Pero si alguna característica tienen las herramientas CRISPR es su versatilidad y aplicabilidad en múltiples campos de la biotecnología y de la biología básica. Como el ejemplo que traigo hoy para comentar. Los primeros animales marsupiales editados genéticamente con CRISPR.
La modificación genética de animales empezó en los 70 y se afianzó en los 80 en EE.UU., y comenzó en ratones. Gracias al conocimiento detallado que se tenía del ciclo reproductor biológico del ratón, a la sencillez para acceder a óvulos fecundados, el desarrollo tecnológico para su microinyección, junto con los procedimientos desarrollados para retornar los embriones microinyectados al oviducto de otras ratonas para su gestación, se logró obtener los primeros ratones transgénicos en 1980. Para el traslado de la tecnología a otras especies hacía falta disponer de un conocimiento parejo en los temas anteriores en la especie en cuestión, algo que se logró en varios animales de granja en 1985 (ovejas, cerdos y conejos). Sin embargo, en todos estos casos se trataba de «añadir» nuevo ADN, un nuevo gen a las especies, un trasgén, por eso los animales resultantes se llamaban transgénicos. En el ratón, gracias a aislar las células troncales embrionarias (células ES, del inglés Embryonic Stem) en 1981, se pudo desarrollar una técnica para «inactivar» genes del genoma del ratón a voluntad, generando estirpes de ratón deficitarias en un solo gen (los ratones knockout), cuyo primer ejemplo conocimos en 1987. Los investigadores Martin Evans, Mario Capecchi y Oliver Smithies desarrollaron de forma independiente los elementos para llevar a cabo estas técnicas de eliminación génica selectiva, por las que recibieron, los tres, el Premio Nobel de Medicina en 2007. Sin embargo, estas células ES solo las conocíamos en ratones, y sin ellas no era posible inactivar genes específicos en otras especies. El nacimiento de la oveja Dolly cambió el panorama, pues permitió desarrollar animales con modificaciones genéticas, por adición o substracción, mediante transferencia nuclear y así se pudieron generar cerdos, vacas, conejos, ratas, cabras, ovejas, caballos, hurones y hasta primates no humanos con modificaciones genéticas precisas, mediante clonación. Sin embargo, el ejemplo más reciente publicado en macacos, 21 años después de Dolly, y con una eficiencia paupérrima del proceso (~1,5%), similar en los dos casos, nos recordaba las dificultades de modificar genéticamente especies animales no habituales.
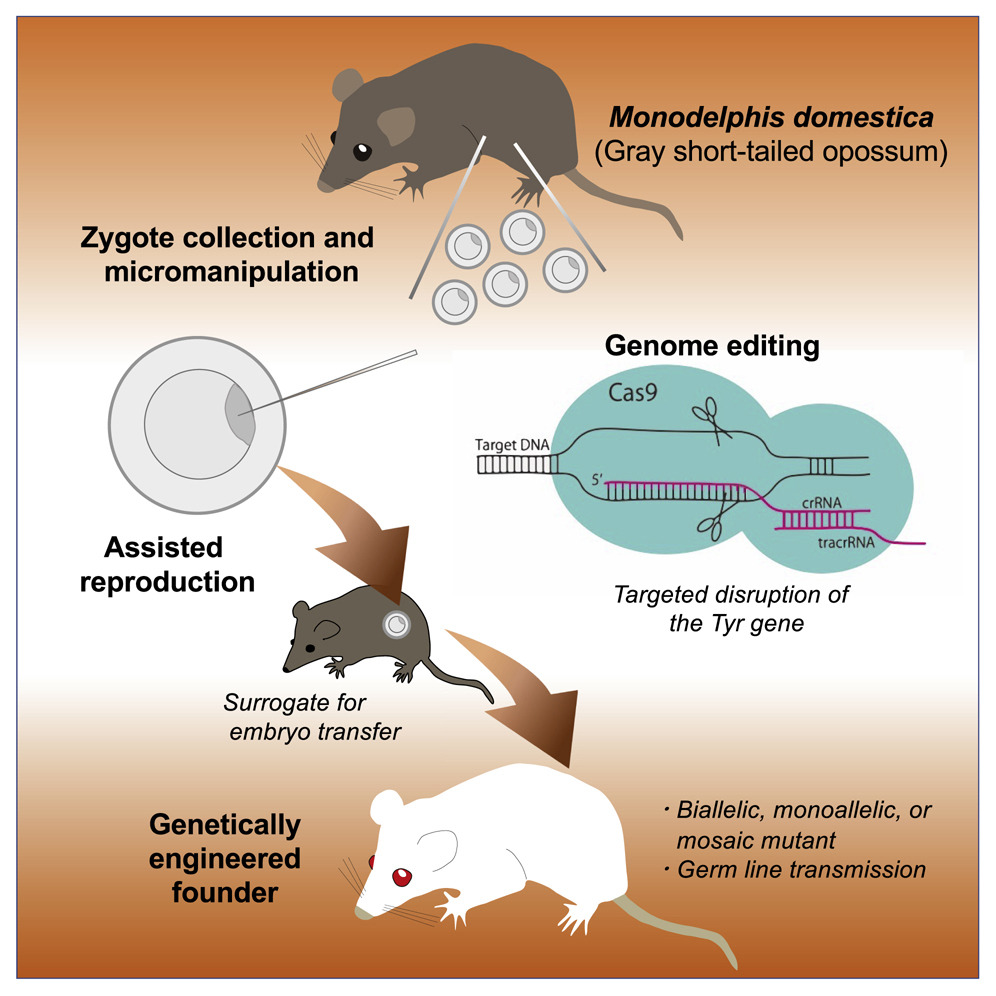
En 2013, el año en el que las herramientas CRISPR empezaron a usarse en muchas especies distintas, rápidamente se demostró que también servían para generar tanto «adiciones» como «eliminaciones» de genes específicas en el ratón. Y la facilidad de su uso rápidamente corrió como la pólvora entre los laboratorios de biología y genética molécular de todo el mundo universalizándose muy pronto su uso. En 2019 conocimos las primeras lagartijas editadas genéticamente y albinas. También con ellas los investigadores habían usado las herramientas CRISPR para inactivar el mismo gen Tyr, que codifica la enzima tirosinasa, y que realiza el paso principal en la síntesis del pigmento melanina.
En este nuevo trabajo, publicado en la revista Current Biology y comentado en la revista Science, unos investigadores japoneses del Laboratory for Animal Resources and Genetic Engineering, RIKEN Center for Biosystems Dynamics Research, en Chuou-ku, Kobe, Japón, decidieron aplicar las herramientas CRISPR para cortar e inactivar el gen Tyr de un marsupial, la zarigüeya gris de cola corta (Monodelphis domestica). A diferencia de otros mamíferos marsupiales estas zarigüeyas, de origen sudamericano, no tienen una bolsa abdominal donde proteger a sus crías recién nacidas, que nacen infra-desarrolladas (como sucede por ejemplo con los canguros). Las crías de esta zarigüeya nacen igualmente subdesarrolladas pero rápidamente trepan hasta enganchar alguno de los 13 pezones libres de la madre, del que cuelgan 3-4 semanas hasta el destete. El genoma de esta zarigüeya fue el primer genoma secuenciado de un marsupial.
Los marsupiales son un grupo de mamíferos vivíparos, a diferencia de los monotremas (como el ornitorrinco y el equidna, que son ovíparos) y como los placentarios (o euterios, como nosotros, que también somos vivíparos). Actualmente hay unas 270 especies de marsupiales, 70 en Sudamérica y las otras 200 en Australia, y su característica más destacada es que sus crías completan el desarrollo después de nacer. En los mamíferos placentarios las crías se desarrollan enteramente en el útero de las hembras, durante la gestación, que es completa. La biología y la genética de los marsupiales puede aportarnos mucho conocimiento para entender mejor la evolución de los mamíferos, pero para ello se necesitan modelos experimentales en los que sea posible modificar genéticamente el genoma de alguno de estos marsupiales. Esta es la gran aportación de este nuevo estudio con CRISPR. Permitir que el genoma de un marsupial sea también editable.

El experimento realizado por estos científicos del RIKEN implica seleccionar dos guías de ARN dirigidas contra el cuarto exón del gen Tyr del genoma de la zarigüeya, para promover la deleción de un fragmento del gen y, con ello, su inactivación. Las crías nacidas fueron algunas albinas (lo cual implicaba que la deleción había ocurrido en los dos alelos del gen, el paterno y el materno, en prácticamente el 100% de las células) y otras fueron quimeras, en las que la inactivación solamente había ocurrido en algunas células durante el desarrollo embrionario, dando lugar a estos animales mosaicos.
Los investigadores también tuvieron que establecer las técnicas de ovulación, de microinyección de unos embriones distintos a los habituales de ratón, con una cubierta mucoide muy densa que requirió el uso de piezoinyectores (microinyectores acoplados a un motor de vaivén que permite penetrar estas capas protectoras del zigoto sin dañarlo), de sincronización de las hembras para la transferencia exitosa de embriones, etc., pero contaron con la gran ayuda de las CRISPR, lo cual les permitió obtener unas eficiencias impensables con cualquiera de los métodos de modificación genética anteriormente comentados. Tras la edición con CRISPR de los embriones de zarigüeya y su implante para la gestación les nacieron 19 crías de zarigüeya, y en 15 de ellas detectaron corte en el gen Tyr mediante métodos moleculares. De estas 15 crías, cinco eran totalmente albinas (la inactivación del gen Tyr había ocurrido en los dos alelos), dos eran mosaico (la inactivación del gen Tyr solo había ocurrido en algunas células durante el desarrollo embrional) y, el resto, ocho crías, eran aparentemente pigmentadas pero portadoras de alelos Tyr inactivados. ¡Todo un éxito!
Una vez más se demuestra que las herramientas CRISPR no tienen límite a su versatilidad y ámbito de aplicación. Su límite está en la imaginación de los investigadores, como digo yo siempre e incluyo en mi libro: Editando genes: recorta, pega y colorea.


Enhorabuena por el artículo
Leyendo el artículo me hago una idea de la potencialidad de CRISPR con modificaciones a partir de células embrionarias.
Seguramente lo haya explicado en alguna otra ocasión pero me gustaría conocer que posibilidades tiene CRISPR de corrección del ADN en individuos ya fuera del proceso embrionario. En algún conocido documental se muestra un niño con anemia falciforme en proceso de curación mediante CRISPR pero no se muestran después los resultados.
Por último y saliendome del tiesto, estos días me azota una duda, si el ADN (o ARN) son las «instrucciones» o «el guión» que condicionan la funcionalidad de un determinado ser vivo ¿qué guión siguen un producto de las mismas como son las proteínas? Profundizando en su composición uno llega a los aminoácidos y de hay a los átomos ¿dónde está el «guión»?
Gracias por divulgar el conocimiento y por todo lo que aprendemos de sus artículos y videos, profesor.
Salut!
Fran
Hola, gracias por su comentario. En relación al uso de CRISPR para el tratamiento de la anemia falciforme lo expliqué en este otro artículo de mi blog:
https://montoliu.naukas.com/2019/12/01/curando-reprimiendo-al-represor/