
El laboratorio de la investigadora y divulgadora Alison Van Eenennaam (UC Davis, CA, EEUU) acaba de presentar un ternero macho, de nombre Cosmo, que porta copias adicionales del gen SRY, que es el factor determinante del sexo masculino en mamíferos. Estas copias han sido introducidas en otro cromosoma del genoma del animal, mediante edición genética con las herramientas CRISPR. Se espera que la descendencia de este ternero esté sesgada hacia machos, exactamente 75:25. De confirmarse, sería un primer paso hacia la aplicación de soluciones biotecnológicas innovadoras en ganadería para obtener más machos (que aprovechan mejor el forraje para convertirlo en carne de consumo) que hembras.
En mamíferos la determinación genética del sexo corre a cargo, fundamentalmente, de un gen maestro llamado SRY que viaja en el pequeño cromosoma Y (en comparación con el gran tamaño del cromosoma X). Por ello, normalmente, los individuos masculinos de una especie (machos) tienen un cariotipo heterogéneo de cromosomas sexuales (XY) mientras que los individuos femeninos (hembras) suelen tener un cariotipo homogéneo (XX). La activación del gen SRY desata una cascada de acontecimientos moleculares y celulares responsables de que ese individuo desarrolle los órganos sexuales masculinos. Por el contrario, en ausencia del gen SRY (que es lo que sucede si portas dos cromosomas X) no se activa el programa masculino y, en su lugar, el que opera por defecto es el programa de desarrollo que determina la aparición de los organos sexuales femeninos. Los seres humanos tenemos 23 pares de cromosomas en un cariotipo normal, 22 pares de cromosomas autosómicos y 1 par de cromosomas sexuales. Por eso el cariotipo de una persona con sexo masculino suele expresarse así: 46,XY y el de persona con sexo femenino así: 46,XX. Este esquema se cumple en todas las especies de mamíferos, con algunas variaciones específicas de cada especie relativas a los genes efectores que transducen la señal iniciada por el gen SRY. La proteína codificada por el gen SRY es un factor de transcripción, esto es, que se une a la zona promotora/reguladora de otros genes y determina su encendido, su activación.
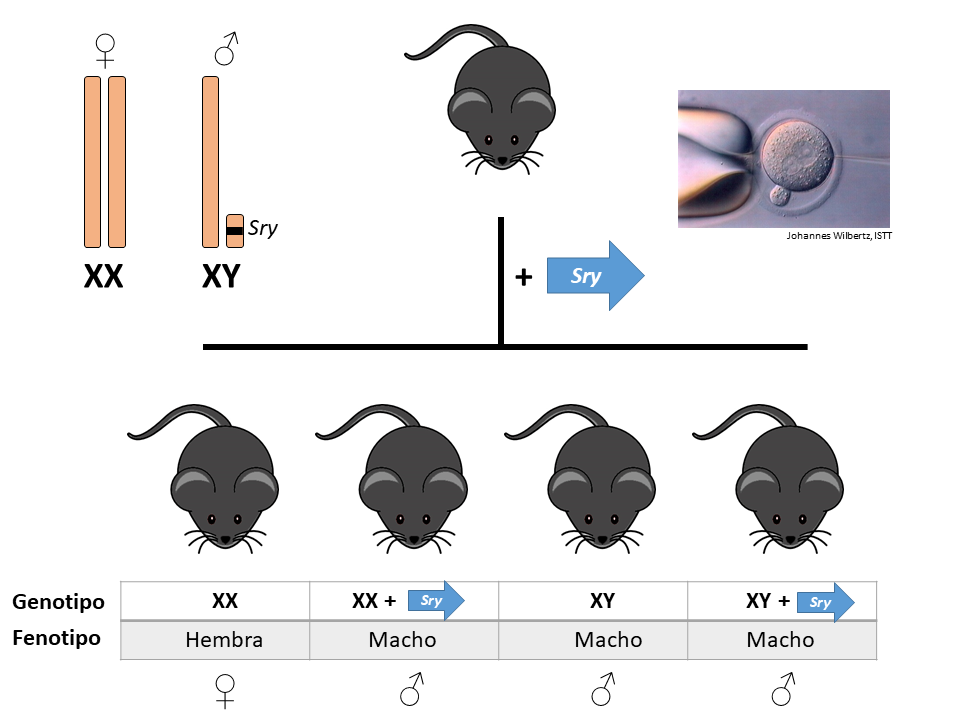
La importancia del gen SRY en la determinación del sexo en mamíferos fue establecida por el laboratorio de Robin Lovell-Badge en 1990, con varios artículos seminales que demostraban el papel fundamental de este gen Sry en la determinación del sexo en ratones. Estos mismos investigadores generaron en 1991 el que probablemente sea el segundo ratón transgénico más famoso de la historia (tras la medalla de oro que indiscutiblemente se lleva el ratón que generaron en 1982 Richard Palmiter y Ralph Brinster, con un transgén inducible con el gen de la hormona del crecimiento, que producía ratones transgénicos ~2,5 veces mayores que sus hermanos de camada no transgénicos. Ese fue el experimento inicial que algunos años después llevaría a desarrollar el salmón transgénico de forma muy similar). El laboratorio de Lovell-Badge introdujo el gen Sry como transgén en embriones de ratón y obtuvo los correspondientes animales transgénicos. Aquellos que eran XY se desarrollaban como machos, estuviera presente o no el transgén SRY en alguna otra parte del genoma. Pero los animales que eran XX (y que deberían haberse desarrollado como hembras) en ocasiones se desarrollaban como machos, si habían incorporado el transgén Sry en su genoma, lo cual permitía activar el desarrollo de los órganos sexuales masculinos. En definitiva se obtenían más ratones macho de los que esperaríamos, pues el transgén Sry era capaz de reactivar el programa de desarrollo masculino desde cualquier otro lugar del genoma, no necesitaba estar residiendo en su localización normal en el cromosoma Y.

Casi 30 años después, el laboratorio de Alison Van Eenennaam ha diseñado un experimento similar al que desarrolló Robin Lovell-Badge: introduciendo copias transgénicas del gen SRY del genoma vacuno con la esperanza que los resultados sean igualmente espectaculares, y estos animales transgénicos den lugar a una proporción mayor de machos que de hembras en sus descendientes. Hemos conocido el resultado preliminar del experimento (el nacimiento del ternero macho Cosmo) gracias a un artículo en la revista Wired, una nota de prensa de la UC Davis y a un póster presentado por los autores del trabajo en el congreso anual de la American Society for Animal Science (ASAS2020). La investigadora principal de este estudio, Alison Van Eenennaam también se refirió a Cosmo en su reciente intervención en el congreso GWG2020 de la Genome Writers Guild. Además de este artículo, la genetista Gemma Marfany (UB) se refirió anteriormente a Cosmo en su artículo semanal en el periódico El Nacional.
El resumen del experimento que dio lugar al nacimiento de Cosmo es el siguiente: el laboratorio de Alison Van Eenennaam, de la UC en Davis, junto a Jim Murray y Pablo Ross, del mismo departamento de Animal Science de esta prestigiosa universidad, y otros colaboradores, decidieron alterar la distribución de sexos en la progenie del ganado vacuno (habitualmente 50% toros y 50% vacas, como cualquier otro mamífero) mediante la introducción de copias extra del gen SRY (habitualmente presente en el cromosoma Y) en otro cromosoma. El objetivo perseguido era que los terneros que se obtengan tiendan a ser machos antes que hembras. Que en lugar de la relación entre machos/hembras (terneros/terneras) al 50:50 propicien una relación a 75:25 a favor de machos, que se sabe son un 15% más eficientes convirtiendo forraje en carne. Esta modificación tendría un evidente impacto económico positivo en ganadería destinada a producción de carne. De toda esta propuesta ha nacido un solo ternero, Cosmo, portador de copias adicionales del gen SRY que ahora habrá que investigar y analizar, tanto a él como a su progenie.
Hasta aquí la perspectiva histórica del descubrimiento del gen SRY, las notas de prensa y los artículos de divulgación sobre el ternero Cosmo, que resaltan la decididamente ingeniosa idea subyacente al experimento. Ahora vayamos a revisar los detalles del experimento, que me temo son algo más complicados.
Para llevar a cabo el experimentos los autores deciden usar una construcción genética que incluye una copia extra del gen SRY del genoma vacuno, junto a un gen indicador (el gen GFP, que codifica la proteína verde fluorescente del genoma de la medusa del pacífico Aequorea victoria), y todo la construcción flanqueada por secuencias homólogas al locus H11 (originalmente descrito en el genoma de ratón) sito en el cromosoma 17 vacuno, que se sabe es un lugar neutro, permisivo para la expresión de construcciones exógenas y, por ello, usado anteriormente para la introducción exitosa de transgenes. Los investigadores usaron reactivos CRISPR-Cas9 junto a una guía que cortaba en ambas regiones de homología y en el locus H11, para promover su integración por knock-in, dirigida por homología de secuencias. Según explican en este póster presentado en ASAS2020, microinyectaron 200 embriones (zigotos), 22 llegaron a blastocisto y 9 de ellos eran fluorescentes, lo que indicaba la probable integración de la construcción. Transfirieron estos embriones verdes a hembras sincronizadas y obtuvieron una gestación que finalmente dio lugar a un ternero macho, Cosmo.
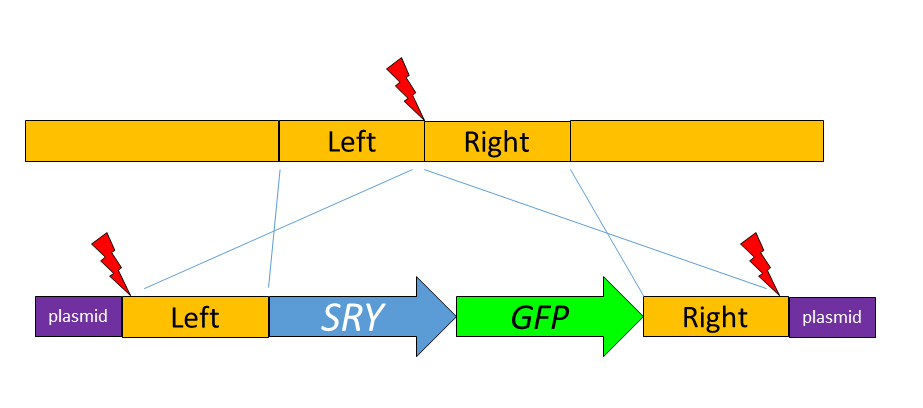
¿Cuál es el cariotipo de este animal fundador? Pues se trata de un ternero XY, por lo tanto macho. ¿Cuál es el genotipo de este animal en relación al transgén? Pues, como podríais sospechar, relativamente complejo, con diversos alelos identificados. El análisis genómico tanto de la placenta como de células de la sangre de Cosmo, como de una línea de fibroblastos derivada de la piel de Cosmo, muestran la existencia de, por los menos, tres alelos distintos. En uno de ellos se ha producido una inserción de 26 bp en el sitio de corte, en otro se han incorporado siete copias de la construcción SRY+GFP, en tandem y en diferentes orientaciones, y una copia del plásmido usado en la construcción y, un tercer alelo con tres copias de la construcción SRY+GFP y una copia del plásmido. Este tercer alelo comentan los autores que parece derivado del segundo, por reorganización interna. Esto es lo que ocurre normalmente al aplicar CRISPR sobre embriones de cualquier especie de mamífero, sean de ratón, de vaca o humanos. Se llama un animal mosaico, y es lo que obtendría habitualmente cualquiera que use CRISPR para generar animales editados. Por ello, no debería sorprendernos. Pero es algo que complica todos los análisis posteriores. Desafortunadamente, no se trata de una inserción limpia de una copia del gen SRY en un sitio adicional del genoma, como estoy seguro habían planeado. Son alelos insertados bastante más complejos.
Cosmo es un animal transgénico, pues incorpora secuencias foráneas (GFP y plásmido), además de propias (SRY) en lugares ectópicos, en los alelos identificados. Cosmo es en realidad un experimento de prueba de concepto con el que pretenden demostrar que es factible obtener un sesgo en el sexo de los descendientes, si estos heredan las copias del transgén que contienen el gen SRY. Pero para ello será necesario estudiar la transmisión por vía germinal de todos estos alelos, y segregarlos entre la descendencia. En el supuesto que los descendientes de estos animales se quisieran destinar al consumo (que no es el caso), la FDA requeriría un dossier de experimentos para evaluar los posibles riesgos de la modificación genética introducida en el animal, en los futuros consumidores y en el medio ambiente, antes de proceder a aprobar este animal para el consumo humano, lo cual puede llevar años (como acabamos de comprobar con los más de 30 años que ha costado llevar el salmón transgénico AquAdvantage a la mesa). Alison Van Eeneennaam es experta en el análisis fenotípico pormenorizado y sistemático de la descendencia de ganado vacuno editado genéticamente, como demostró el año pasado al analizar las generaciones filiales derivadas del toro portador de la mutación Polled, responsable del fenotipo hornless (sin cuernos).
También les queda demostrar lo obvio. Cosmo es un ternero macho, pues es XY. Y, además, lleva los alelos SRY mencionados. Lo importante será ver el fenotipo sexual de terneras cromosómicamente hembras XX hijas de Cosmo, que hayan heredado alguno de los dos alelos con la construcción SRY en el cromosoma 17, para constatar si se desarrollan sexualmente como machos, tal y como la hipótesis del experimento plantea, y, si son fenotípicamente indistinguibles de los machos XY con y sin copias adicionales del gen SRY.
Un largo camino a recorrer todavía. Pero un experimento fascinante que demuestra, una vez más, cómo se pueden aplicar las estrategias genéticas más innovadoras en biotecnología animal para, en este caso, alterar la proporción de sexos en favor de los machos, y así aumentar el aprovechamiento de los animales en ganadería. Un nuevo éxito en la carrera de esta investigadora y divulgadora científica de referencia en Biotecnología Animal cuya conferencia reciente en el meeting GWG2020 merece ser vista por biotecnólogos de ambos lados del océano Atlántico.

