
Esta semana pasada hemos descubierto datos esperanzadores para el futuro uso de las herramientas CRISPR de edición genética como potenciadoras de las estrategias inmunoterapéuticas para tratar a pacientes con cáncer. Sí, digo futuro uso, porque lo que hemos conocido tras el experimento abordado por el equipo de Carl June (Universidad de Pensilvania, Filadelfia, EEUU), publicado en la revista Science, no son los resultados de un tratamiento, sino los primeros datos de un ensayo clínico para evaluar su factibilidad y seguridad (toxicidad), que son dos temas bien diferentes. Tras leer algunos de los muchos artículos que se han publicado sobre este experimento creo que es oportuno intentar explicar lo que han conseguido estos investigadores estadounidenses y qué repercusión real puede tener en futuros tratamientos contra el cáncer.
A tres personas adultas, mayores de 60 años, dos mujeres y un hombre, las tres pacientes de cáncer (uno con sarcoma y los otros dos con mieloma múltiple, un cáncer que afecta a las células de la sangre) les han reinyectado linfocitos T (un tipo de glóbulos blancos que tenemos en la sangre) previamente extraídos de cada uno de ellos, tras modificarlos y seleccionarlos en el laboratorio. Se trata pues de una terapia celular ex-vivo (realizada fuera del paciente, con células de la sangre extraídas de los pacientes). En el laboratorio los investigadores aislaron linfocitos T de la sangre de los pacientes, y, sobre ellos, aplicaron una estrategia de edición genética para inactivar, mediante las herramientas CRISPR-Cas9, tres genes importantes del sistema inmunológico: los genes de las cadenas alfa y beta del receptor de las células T y el gen del receptor PD-1. Cada uno de estos genes está en un cromosoma diferente (los seres humanos tenemos 23 pares de cromosomas). Por ejemplo, el gen que codifica la cadena alfa del receptor de células T está en el cromosomas 14, el que codifica la cadena beta en el 7 y el que porta la información genética del receptor PD-1 está en el cromosoma 2. La inactivación específica de genes es la aplicación más sencilla, y la más eficiente también, que permite la edición genética con CRISPR. Los investigadores usaron RNPs (ribonucleoproteínas), esto es, la proteína Cas9 recombinante combinada con guías de ARN complementarias a los tres genes mencionados, llamados técnicamente TRAC, TRBC y PDCD1, respectivamente.
¿Por qué querían inactivar estos tres genes? Brevemente, para que los linfocitos T resultantes fueran capaces de luchar más eficazmente contra las células cancerosas. Los linfocitos T usan unas proteínas que disponen en el exterior de la célula (se llaman receptores) para reconocer otras células y decidir si deben atacarlas o dejarlas en paz. Esta labor de reconocimiento la realiza habitualmente el receptor de células T, que tiene dos cadenas proteicas, alfa y beta, codificadas por los genes TRAC y TRBC. Hay muchos tipos de receptores de células T. Sin embargo los investigadores querían suprimir toda esta diversidad de receptores para dotar a esos linfocitos T de un receptor transgénico (diseñado en el laboratorio), capaz de detectar específicamente las células tumorales. Y, claro, para evitar que coexistieran en un mismo linfocito T sus propios receptores con el nuevo diseñado en el laboratorio (y para evitar también que se mezclaran sus cadenas alfa y beta) decidieron inactivar los dos genes endógenos TRAC y TRBC, mediante edición genética con CRISPR, produciendo así unos linfocitos T sin receptores T.
¿Por que inactivaron, además, el otro gen, PDCD1? El receptor PD-1 fue descubierto por Tasuku Honjo, quien, junto a James Allis recibió el premio Nobel de Medicina en 2018 por sentar las bases de la inmunoterapia del cáncer. El receptor PD-1 actúa como un regulador negativo del sistema inmunológico. Viene a ser un «freno» para la respuesta inmune. Honjo descubrió que inhibiendo al receptor PD-1 se podía conseguir una respuesta más eficaz de los linfocitos T en su lucha contra el cáncer. Al eliminar el «freno» se desataba una respuesta más importante. Por eso el equipo de Carl June decidió inactivar también el gen PDCD1 en los linfocitos T de estos pacientes. La inactivación del receptor PD-1 en linfocitos T para potenciar su respuesta frente a tumores fue una estrategia que ya plantearon y llevaron a cabo investigadores chinos en 2016.
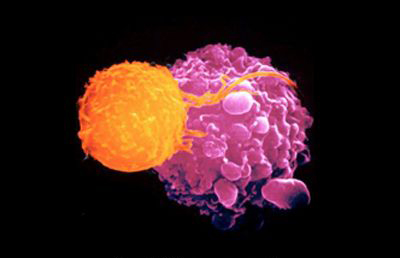
Una vez inactivados los tres genes mediante CRISPR los linfocitos T fueron nuevamente modificados genéticamente, pero esta vez mediante el uso de unos vectores virales, unos lentivirus. Estos virus llevaban en su interior la información genética para producir un nuevo receptor de células T (recordemos que los linfocitos tenían inactivados los dos genes necesarios para generar un receptor de células T propio). Y no era un receptor cualquiera. Era un receptor diseñado para reconocer y eliminar las células cancerosas. En concreto, un receptor programado para reconocer un antígeno (una molécula que las células tumorales muestran en su exterior, expuesta) característico de sarcomas, melanomas y mielomas múltiples (los tres pacientes del ensayo tenían precisamente sarcoma y mieloma múltiple), tres tipos de cáncer muy agresivos, llamado NY-ESO-1. Un linfocito T equipado con un receptor de células T que detecta el antígeno tumoral NY-ESO-1 localizará y eliminará las células cancerosas marcadas con esta señal. Los lentivirus son un tipo de retrovirus que necesitan integrar su carga genética en el genoma de las células que infectan. Así pues, los lentivirus recombinantes portadores de los dos genes para las dos cadenas alfa y beta del receptor contra NY-ESO-1 se insertaron en el genoma de estos linfocitos T.
Estos linfocitos T así modificados (primero editados y luego transfectados con lentivirus) fueron analizados y reinfundidos a cada uno de los tres pacientes del estudio. Cada paciente recibió sus propios linfocitos T previamente extraídos, pero ahora ya modificados. Todo este proceso formaba parte de un ensayo clínico aprobado NCT03399448 que registró el equipo del Dr. Carl June, de UPENN en Filadelfia. Inicialmente reclutaron 6 pacientes de cáncer (que ya no respondían a tratamientos convencionales de quimioterapia), pero solo obtuvieron linfocitos T modificados con éxito en cuatro. De estos 4 uno no pudo continuar en el estudio al cambiar su estado clínico, que ya no era compatible con los criterios del estudio. Los tres restantes son los que recibieron sus linfocitos T editados y modificados genéticamente: dos pacientes con mieloma múltiple avanzado y uno con sarcoma. Unos días antes de recibir la reinfusión de sus linfocitos T modificados los tres pacientes finalmente seleccionados recibieron sendas dosis de las drogas ciclofosfamida y fluradabina, para eliminar sus propios linfocitos T presentes en el cuerpo, antes de reinyectarles los linfocitos T modificados en el laboratorio.

Las eficiencias obtenidas de edición genética de los linfocitos T y de transducción con los lentivirus no fueron ni mucho menos del 100%. Es decir, no todos los linfocitos se modificaron tal y como planeaban los investigadores. Los datos que aportan en el artículo en Science indican que inactivaron el gen TRAC en un 45% de ellos, el gen TRBC en un 15% y el gen PDCD1 en un 20% de las células. Por otra parte los datos de expresión del receptor contra NY-ESO-1 indicaron que habían logrado modificar entre un 2 y un 7% de los linfocitos T con este receptor transgénico. A pesar de todo, a pesar de estos valores limitados hicieron unos experimentos cocultivando estos linfocitos T modificados con células cancerosas y observaron la eliminación efectiva de estas últimas. Dado que usaron RNPs con Cas9 sobre esos linfocitos podrían haber quedado restos de la nucleasa Cas9, que ahora sabemos que es inmunogénica en la mayoría de las personas, gracias a los experimentos que llevó a cabo el laboratorio de Matt Porteus (Stanford Uni., California, EEUU). Estos investigadores detectaron cantidades ínfimas de Cas9 en los linfocitos T finales ya modificados y, en cualquier caso, no detectaron respuesta inmunológica a Cas9 en los pacientes tratados (quizás también por el tratamiento inmunosupresor que habían recibido previa a la reinfusión de los linfocitos T modificados).
La reintroducción de los linfocitos T modificada fue tolerada sin serios efectos adversos por los tres pacientes. Los linfocitos T modificados pudieron ser detectados en la sangre de los pacientes 3 meses y hasta 9 meses después de la reinfusión, aunque en número variable y con valores lógicamente decrecientes. El análisis de los linfocitos T editados permitió detectar algunas pocas ediciones no deseadas en secuencias de ADN similares (mutaciones off-target) a alguno de los tres genes inactivados, aunque ninguna capaz de producir el crecimiento descontrolado de estos linfocitos T editados. Sí detectaron también traslocaciones cromosómicas. Al estar situados los tres genes inactivados en tres cromosomas distintos se podían producir uniones anómalas, inesperadas, de los fragmentos resultantes de los cromosomas. Efectivamente así las detectaron en los tres pacientes aunque el número de células T modificadas con traslocaciones cromosómicas también pareció decrecer con el tiempo, indicando que no tenían una ventaja selectiva frente a las células correctamente editadas.
Dos de los tres pacientes tratados manifestaron una situación estable de su enfermedad (sin mejora pero también sin emperoramiento). Uno de los pacientes mostró una regresión inicial de su tumor tras el tratamiento, pero el efecto no se mantuvo más allá de cuatro meses. Finalmente uno de los pacientes (con mieloma múltiple) murió y los otros dos empeoraron y empezaron a recibir tratamientos alternativos.

Podemos constatar que el beneficio para estos tres pacientes ha sido limitado. No se han curado de sus cánceres. Pero hay que recordar en estos momentos que este estudio no es todavía un tratamiento terapéutico para curar el cáncer. Se trata de un ensayo clínico de fase I, cuyos objetivos son validar si el procedimiento es factible y, sobre todo, si es seguro. En este sentido el estudio ha sido un éxito pues el procedimiento se ha podido completar en tres pacientes de los seis inicialmente reclutados y, en los tres pacientes tratados, las células T modificadas se han incorporado sin problemas en los pacientes (y han podido ser detectadas hasta 9 meses tras su reinfusión), sin generar rechazo ni respuestas inflamatorias, y sin generar una respuesta inmunológica debida a la nucleasa Cas9. Es un procedimiento terapéutico factible y seguro, no es tóxico. Y eso es lo relevante. Por eso es un éxito!
Adicionalmente, a pesar de que se detectaron mutaciones off-target y traslocaciones, estas no parecieron afectar a la viabilidad de la mayoría de los linfocitos T modificados. En al menos uno de los pacientes los investigadores interpretaron que los linfocitos T modificados habían pasado ya a formar parte de la memoria inmunológica del paciente. La inactivación del receptor PD-1 puede conllevar la aparición de autoinmunidad, que los linfocitos T ataquen a las propias células sanas del individuo. Sin embargo, los investigadores no detectaron señales de autoinmunidad en estos tres pacientes.
Se trata de unos primeros resultados, esperanzadores, pero todavía preliminares. No son definitivos ni sirven para autorizar tratamientos, todavía. Se necesitarán bastantes más pacientes para acabar de analizar la seguridad y factibilidad del tratamiento. Los investigadores iniciaron la solicitud de ensayo clínico en 2016, y los reactivos que les aprobaron para su uso no son los que tenemos hoy en día, en el año 2020, mucho más evolucionados. Esto es especialmente cierto con los reactivos CRISPR-Cas9, que han evolucionado muchísimo. Con los reactivos y estrategias actuales esperarían unos porcentajes de edición genética mucho mayores.
Por eso el título de este artículo es «Seguridad de las herramientas CRISPR para futuros tratamientos contra el cáncer«, que es nada más y nada menos que lo que han conseguido estos investigadores norteamericanos. Todavía no han curado el cáncer, todavía no podemos hablar de tratamientos para combatir tumores agresivos como los sarcomas o los mielomas múltiples, pero sí podemos decir que estamos hoy un poco más cerca de lograrlo.


Alucinante !
Estas informaciones sobre el cáncer hace mucho tiempo que se hacen y siempre son lo mismo.
Al final la noticia es que queda mucho todavía, pero cada vez menos. Ya sabemos que se curan más que antes pero también se mueren más que antes y no me digan que es por la esperanza de vida, ya que toda la gente que conocí y son muchas, no eran gente mayor.
El cáncer infantil es un ejemplo de ello.
La realidad es, afortunadamente, que cada vez se diagnostican antes los tumores y cada vez hay más cánceres que pueden tratarse y curarse. Es cierto que en algunos tipos de cáncer (melanoma, páncreas…) el progreso es menor y siguen siendo muy agresivos, pero en general los datos nos dicen que la investigación biomédica ha dado sus frutos reduciendo mortalidades debidas a estas patologías.
En EEUU: https://www.cancer.gov/espanol/cancer/naturaleza/estadisticas
En España: https://seom.org/dmcancer/cifras-del-cancer/
cordiales saludos
Lluis
Algo tan complejo y qué bien explicado.
La tecnología CRISPR con la transducción del lentivrus me parece impresionante.
Muchas gracias Marisa!
Hola,
Todo lo que se puede hacer con crispr es muy interesante y esperanzador.
Me gustaría saber si se podrá corregir una mutación de un gen, concretamente TP.53 también llamado «guardián del genoma» y si es así, cuándo cree que se pondrá en marcha?
Gracias.
Cualquier mutación genética podría, en principio, corregirse con el sistema CRISPR. Pero todavía no es del todo seguro realizar estos experimentos en personas. La mayoría de ensayos clínicos son ex vivo, no in vivo, con la excepción de un solo caso. Por el momento.
Wow…!! es fascinante todo este mundo de la genética
En mis planes esta estudiar genética, espero lograrlo y aportar algo significativo a la humanidad